
Projekt der Stufe 11 : Aufbruch in die Moderne – Chemie (Wö) – Die Ammoniaksynthese und ihre Bedeutung


Die Ammoniaksynthese und ihre Bedeutung

Die Themen
Ammoniak und seine Bedeutung zur Ertragssteigerung in der Landwirtschaft unter geschichtlichen Aspekten
von Jakob Zeitz und Lynn Nolte
Ammoniak und seine Bedeutung in der Kriegswirtschaft
von Jan Kozak und Sabrina Hurschmann
Die Verantwortung des Wissenschaftlers bei der Anwendung von Forschungsergebnissen
von Benjamin Jacob und Gerhard Guist
Ammoniak – chemische und physikalische Eigenschaften
von Katharina Przibilla und Christina Kühr
Porträt : Haber
von Lisa Schmid und Thomas Drulla
Porträt : Immerwahr
von Daniel Frick und Sebastian Glock
Ammoniakdüngung und landwirtschaftliche Ertragssteigerung in der Gegenwart
von Christopher Hahne und Patrick Martel
Ammoniakdüngung und Folgen für die Ökologie
von Andreas Cronrath und Benjamin Sander
Auswirkungen auf Mensch und Umwelt
von Miriam Thill und Dominik Rüsche
Die Ammoniaksynthese - geschichtliche Aspekt
von Lena Herting und Rebecca Spence
Chemische Grundlagen der Ammoniaksynthese
von Maja Ribinski/Arthur Maz und Vanja Stojanova/André Babinsky
Großtechnische Aspekte der Ammoniaksynthese
von Alina Kaufmann /Daniel Warwel und Martha Chudzinski /Ying-Cai Wang
Ammoniak und seine Bedeutung zur Ertragssteigerung in der Landwirtschaft
von Jakob Zeitz
Ammoniak spielte um 1910 in der Landwirtschaft in Form von Ammonsulfatdünger eine große Rolle da der Dünger aus Tierexkrementen immer weniger zu Verfügung stand 1) .
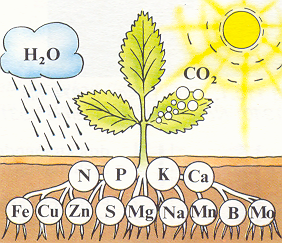
Pflanzen brauchen zum leben Stickstoff, der zwar in der Luft in großen Mengen vorkommt (78 Vol-%), jedoch von Pflanzen kaum genutzt werden kann. Das liegt daran, dass der Stickstoff (chemisches Zeichen „N“) Molekular, das heißt nicht als einzelnes Atom vorkommt (N2). Pflanzen können nur elementaren Stickstoff aufnehmen.
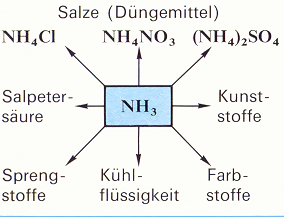
Die Lösung des Problems kam mit der industriellen Herstellung von Ammoniak. Ammoniak (NH3) stellt Pflanzen den Stickstoff zur Verfügung den sie brauchen. Rund 4/5 des industriell hergestellten Ammoniaks werden bei der Weiterverarbeitung in Düngemittel weiterverarbeitet.2) Durch die verhältnismäßig kostengünstige Herstellung kann eine Ertragssteigerung erzielt werden.
Nachteile der Düngung mit Ammoniak sind die Verseuchungen durch Überdüngung, was sich z.B. durch Blattabwurf bemerkbar machen kann, und die Emission von Ammoniak. In Deutschland liegt die Belastung in etwa zwischen 1 - 3 µg NH3 pro m3 Luft. Mit Niederschlägen gelangen diese auf den Boden und in die Pflanzen („saurer Regen“). Weil Ammoniak sich gut in Wasser löst, dringt es rasch in das Grundwasser und die Böden. 3)

Quellen :
Einsichten und Perspektiven 04-2004.htm
Tausch / v. Wachtendonk – Auflage 1993 – C.C. Buchner-Verlag – Chemie SII – 1993, S.109
http://www.medicine-worldwide.de/pharmakologie/giftstoffe/ammoniak.html
Ammoniak und seine Bedeutung zur Ertragssteigerung
in der Landwirtschaft
von Lynn Nolte
Der Boden ist mit Wasser, Luft, Lebewesen, organischer und mineralischer Substanzen durchzogen. Außerdem ist er die Lebensgrundlage und der Lebensraum für Menschen, Tiere und Pflanzen. Der optimale Boden hat genügend Poren, wo Luft, Wasser, Bodentiere und Wurzeln sich entfalten können. Die im Boden enthaltenen Mikroorganismen und größere Bodentiere zersetzen tote Pflanzen. Hierbei werden Humusstoffe und mineralische Nährsalze gebildet und freigesetzt. Die Entstehung von Tonmineralien und Nährsalzen kommt durch die physikalische und chemische Verwitterung, die den Verbund der Mineralien und deren Aufbau im Gestein zerstört. Als Nährstoffspeicher dienen der Humus und die Tonminerale, diese binden Nährsalze und machen diese den Pflanzen verfügbar. Die im Boden enthaltenen Bakterien machen bei einer Fläche von einem m² Boden, bezogen auf die obersten 30 cm, eine Anzahl von 60.000.000.000.000 aus. Bakterien bauen vor allem komplizierte Kohlen- und Stickstoffverbindungen ab, die Blaualge kann Stickstoff sogar aus der Luft binden. Der Stickstoff ist wichtig für die Eiweißbildung im Boden. Aus organischen Stickstoffverbindungen wird eine Ammoniumform, die Mikroorganismen oxidieren Ammonium zu Nitrat und dieses wird ins Grundwasser gespült.
Bei einem fruchtbaren Boden ist der pH-Wert schwach sauer bis neutral. Wenn man nun Pflanzen anbaut, entziehen sie dem Boden Nährstoffe. Hat der Boden nicht genügend Nährstoffe, verliert der Boden an Fruchtbarkeit. Ziel der Düngung ist nun pflanzenverfügbare Stickstoffe in ausreichender Menge zum richtigen Zeitpunkt bereitzustellen, sodass ein hoher Ertrag möglich wird, ohne unwirtschaftliche und umweltschädigende Stickstoffverluste. Mineraldünger könnte genau dosiert werden, nach entsprechender Bodenanalyse, aber beim Anbau von Sonderkulturen könnte es zu einem überhöhten Düngungsaufwand kommen und dadurch zu erheblichen Umweltbelastungen. Bei diesem Verfahren wird Ammoniak frei. Gelangt dieser in die Atmosphäre, verbindet es sich relativ schnell mit sauren Luftschadstoffen wie Stickoxiden und Schwefeldioxid und es entstehen Ammoniumsalze, die sich als winzige Partikel in der Luft verteilen. In Deutschland liegt die Belastung in etwa zwischen 1 - 3 µg NH3 pro m3 Luft. Mit Niederschlägen gelangen diese auf den Boden und in die Pflanzen ("saurer Regen"). Weil Ammoniak sich gut in Wasser löst, dringt es rasch in das Grundwasser und die Böden1). Ein weiteres Düngungsmittel ist der Tier Kot. In bestimmten Regionen hat die Viehhaltung so stark zugenommen, dass es zu einer Überdüngung kommt. Diese Überdüngung stammt nicht nur von dem viel produzierten Kot, sondern auch von dem aggressiven Flüssigkot. Speicherfähigkeit fällt nach und nach weg. Feine Bodenpartikel verschlammen und verkleben und an den Wurzeln der Pflanzen bilden sich so genannte „Drainagen“, die die Gülle in das Grundwasser leiten. Durch den hohen Ammoniakgehalt in der Gülle reizt es zusätzlich die Haut der Regenwürmer und löst bei diesen eine Fluchtreaktion aus. Die Tiere wandern nun an die Erdoberfläche und sterben durch das UV-Licht einen qualvollen Tod. Auch die Pflanzen zeigen eine Reaktion, sie sterben einen Gülletod. Außer der Mais, er kann mit der vielen Gülle umgehen und ist dadurch eine pflegeleichte und ertragsreiche Pflanze. Pflanzenschutzmittel sind auch keine guten Dünger. Sie sind Gifte, die Tiere, Wildkräuter und Pilze vernichten, aber einen hohen Ertrag erzielen. Sie setzen sich im Boden fest, deshalb ist sie Ernte davon betroffen. Durch das Pflanzenschutzmittel sind die Pflanzen, aber auch die Menschen bedroht. Man kann erkennen, dass Düngungsmittel, wie Biozide, Gülle und Mineraldünger, schlechte Düngungsmittel sind. Sie belasten den Boden, das Bodenleben, den Menschen, die Pflanzen, die Tierwelt und auch das Grundwasser. Durch diese Überdüngung der schlechten Düngungsmittel kommt es zur Ausspülung ins Grundwasser, dass das Grundwasser mit hohen Nitratwerten belastet. Dadurch kann der Mensch das Nitrat aufnehmen, zu Nitrit umwandeln und führt im Darm mit Aminen zur krebserregenden Verbindungen. Nutzpflanzen können schneller krank werden, sterben einen Gülletod und haben später eine schlechtere Qualität. Natürlich haben manche Düngungsmittel einen hohen Ammoniakverlust und Methangasverlust. Dies ist eine Mitursache für das Waldsterben und den Treibhauseffekt.
Der Ammoniak schadet der Umwelt vor allem deshalb, weil dadurch das ökologische Gleichgewicht verändert wird. Von Pflanzen kann Ammoniak als Stickstoffquelle genutzt werden. Über bestimmte Speicher- und Transportformen wird es in den pflanzlichen Stoffwechsel eingeschleust. Deshalb dient die Substanz in Verbindung mit unterschiedlichen Säuren als wichtiges Düngemittel (z.B. Ammoniumdünger, Stickstoffdünger). 85% des erzeugten anorganischen Ammoniaks werden heute für die Gewinnung von Düngemittel genutzt. In zu hohen Dosen kann Ammoniak aber auch auf Pflanzen giftig wirken, die dann z.B. durch Blattabwurf versuchen, die Ammonium-, bzw. Ammoniakkonzentration zu senken. Einige Pflanzen wie Eiben, Fichten oder die Winterlinde reagieren empfindlicher auf Stickstoff, doch die meisten der einjährigen Nutzpflanzen aus der Landwirtschaft sind diesbezüglich weniger anfällig. Insgesamt verändern Ammoniak und Ammonium, ob sie aus der Luft oder durch den Einsatz von Düngemitteln in die Pflanzen gelangen, der Zusammensetzung ganzer Ökosysteme. Denn der düngende Effekt verschiebt die natürlichen Lebensbedingungen für die Pflanzen1).
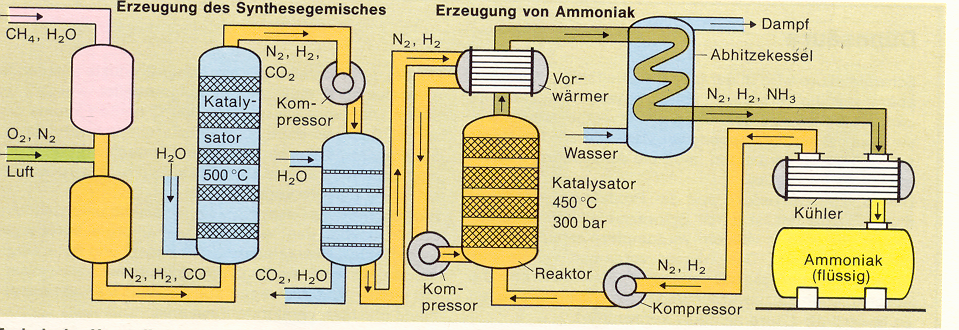
Die Chemiker Haber und Bosch entwickelten zwischen 1905 und 1913 eine Ammoniaksynthese. Sie stellten aus Wasserstoff und Stickstoff Ammoniak her. Dies ist die Reaktionsgleichung zu der Synthese:
N2 +
3 H2 ![]() 2 NH3 HR
= -92 kJ/mol
2 NH3 HR
= -92 kJ/mol
Stickstoff
+ Wasserstoff ![]() Ammoniak
Ammoniak
Haber und Bosch fanden durch langjährige Versuche heraus, dass für die Gleichgewichts-Reaktion zwischen Stickstoff und Wasserstoff unter folgenden Bedingungen am meisten Ammoniak gebildet wird:
1. Bei einer Temperatur
von 500°C
2. Unter sehr hohem Druck: 450 Bar (Atmosphären)
3. Bei folgendem Mengenverhältnis der Ausgangsprodukte:
Stickstoff : Wasserstoff = 3 : 1
(Stickstoff im Überschuss)
4. Beim Vorliegen eines
Katalysators, welcher die Reaktion beschleunigt.2)
Geschichtlicher Aspekt:
Von 1914 bis 1945 gab es viele verschiedene Hochdrucksyntheseverfahren zur Erzeugung von Produkten, die natürliche Stoffe in ihrer Qualität übertreffen sollten. Kurz vor dem ersten Weltkrieg entwickelten Haber und Bosch die Ammoniaksynthese, sie rettete Deutschland zu dieser Zeit, da Ammoniak wichtig für die Herstellung von Sprengstoff und Stickstoffdüngung ist. Die USA entwickelte auch solch ein Verfahren, dies aber als Kalkstickstoffverfahren. Frankreich und Großbritannien bedienten sich in der Zwischenkriegszeit dem Deutschen Verfahren. Ab 1923 fing bei der BASF in Ludwigshafen-Oppau die Großproduktion des synthetischen Methanols an, die durch die gewonnene Erfahrung der Ammoniaksynthese gefördert wurde. Durch die Methanolsynthese fand man heraus, dass durch Veränderung des Drucks, der Temperatur oder des Katalysators andere hochwertige Stoffe herstellbar sind. Nun wollte man versuchen, ob dieses Verfahren auch mit Kohlenstoff funktioniert. Friedrich Bergius (1884 – 1945) arbeitete mit der Theodor Goldschmidt AG in Essen zusammen und leitete die Entwicklung der Kohlehydrierung ein. 1925 übernahm die IG Farben das Patent von Bergius, da ihm die Mittel zur großtechnischen Anwendung fehlten. Matthias Pier (1882 – 1965) übernahm die Forschung.
Quellen:
http://www.seilnacht.com/Lexikon/HaberBo.htm
Ammoniak und seine Bedeutung in der Kriegswirtschaft
von Jan Kozak
Strümpfe oder Dynamit?
Werkzeuge des Friedens und des Krieges liegen nah beieinander:
Ein Großteil des nach dem Haber-Bosch Verfahren synthetisierten Ammoniaks (Synthese: „Aus zwei Stoffen entsteht ein Stoff“) wird heute im großen Maße zur Herstellung von Salpetersäure verbrannt. Diese Salpetersäure bildet heute die Grundlage vieler alltäglicher Industrieprodukte, ist aber zugleich, in Verbindung mit anderen Stoffen, der Grundstoff für die Herstellung von Sprengstoffen aller Art.
Wenn Stickstoff an Wasserstoff gebunden wird, entsteht Ammoniak, eines der wichtigsten Düngemittel. Aus Ammoniak und Sauerstoff erhält man die Salpetersäure.
Behandelt man Zellulose mit Salpetersäure, so entsteht Schießbaumwolle, die Grundlage des Dynamits, behandelt man Zellulose dagegen mit Schwefelkohlenstoff, dann ist das Produkt Kunstseide.
Filmstreifen wiederum werden aus den gleichen Stoffen gewonnen wie Giftgas. Aus Steinkohlenteer gewinnt man Benzol, Phenol und andere Öle, die die Ausgangsprodukte nicht nur für viele Farbstoffe, sondern auch für die wichtigsten und gefährlichsten Giftgase sind.
Dies ist andererseits für viele Menschen auch die Faszination der Chemie:
Die Produktion von seidenen Damenstrümpfen hat mit der von Dynamit große Ähnlichkeit.
(Quellen 2 und 6)
Herstellung von Salpetersäure- Der lange Weg der Optimierung:
Das Problem der Ammoniaksynthese hatten Fritz Haber (1868-1934) und Carl Bosch (1874-1940) gelöst, noch fehlte aber der Weg zur künstlichen Herstellung von Salpetersäure, der zweiten wichtigen anorganischen Grundchemikalie.
Durch Umsetzung von Salpeter mit Schwefelsäure erhielt man zu dieser frühen Zeit Salpetersäure. Die dafür nötige Anlage war jedoch zu umständlich: „In liegenden gusseisernen Zylindern, die von außen beheizt wurden, ließ man Schwefelsäure auf Salpeter einwirken. Die aus der Retorte abziehenden Säuredämpfe wurden in einer Reihe hintereinander geschalteter Steinzeugtöpfe, den Tourils, kondensiert. Die aus dem Touril-System abziehenden Restgase wurden in einfache Rieseltürme geschickt und im Gegenstrom mit Wasser ausgewaschen, wobei verdünnte Salpetersäure anfiel.
Auf die Dringlichkeit einer „besseren Methode“ zur Salpetersäureherstellung wies Fritz Haber in einem Schreiben an Industrievertreter vom 13. Dezember 1913 hin, wobei er jedoch nur auf die landwirtschaftliche Nutzung einging :
„Ich benutze die Gelegenheit, um Ihnen mitzuteilen, dass die Deutsche Landwirtschafts-Gesellschaft mich gebeten hat, der Aufmerksamkeit Ihrer Firma die Umwandlung von Ammoniak in Salpeter ganz besonders nahe zulegen. Nach meinem Eindruck glaubt die Deutsche Landwirtschafts-Gesellschaft, Salpeter in jedem Umfang unterbringen zu können, während sie sich dessen für das Ammoniak nicht getraut."
Doch diese Herausforderung war schon bekannt jedoch war das Ziel die Herstellung von Düngemittel und (noch) nicht von Sprengstoff. Der französische Chemieprofessor Friedrich Kuhlmann (1803-1881) hatte 1838 entdeckt, dass Ammoniak mit einem Platinkontakt zu einer Vorstufe von Salpetersäure oxidiert wird. Damals war aber Ammoniak aus Preisgründen kein geeigneter Rohstoff zur Herstellung von Salpetersäure und so wurde diese Methode zu dieser Zeit nicht angewandt.
Im November 1901 wandte sich der große deutsche Physikochemiker Wilhelm Ostwald (1853-1932) an die Industrie und schlug ein Verfahren zur Oxidation von Ammoniak mit Luft an Platinkontakten vor. Ostwald waren wahrscheinlich die Arbeiten von Friedrich Kuhlmann unbekannt geblieben und so enthielt seine Patentanmeldungen nichts neues oder unbekanntes.
Das
Platinverfahren wurde von ihm und seinem Mitarbeiter Eberhardt Brauer
ausgebaut und ab 1906 für viele Jahre von den Chemischen Werken
der Zeche Lothringen in geringem technischen Maßstab mit
Gaswasser durchgeführt. Das Endprodukt dieses Verfahrens war
schließlich Ammoniumnitrat, von dem 1908 „erst“ ca.
695 t ,aber 1911 schon ca. 1495 t produziert wurden.
Auch bei der BASF (Badische- Anilin- und Sodafabrik), dem größten Unternehmen der chemischen Industrie in der damaligen Zeit, beschäftigten sich Chemiker mit diesem Problem und strebten „synthetischen Chilesalpeter" an. Bei der BASF lagen große Erfahrungen mit Katalysatoren (Reaktionsbeschleuniger) vor. Man wollte im Gegensatz zum Kuhlmann-Ostwald-Verfahren die „Ammoniakverbrennung" preiswerter und um einiges ertragreicher gestalten. Im Herbst 1913 wurden mit den Versuchen begonnen und bereits im Frühjahr 1914 hatte Christoph Beck (1887-1960) eine Lösung gefunden: Ein schon bei der Ammoniaksynthese erprobter, aber erfolgloser Eisenoxid-Wismutoxid-Katalysator zeigte einigermaßen gute Wirksamkeit und nach weiteren Versuchen erwies sich schließlich eine Eisenoxid-Wismutoxid-Manganoxid-Misch-Kontaktmasse als wirksamste Kombination.

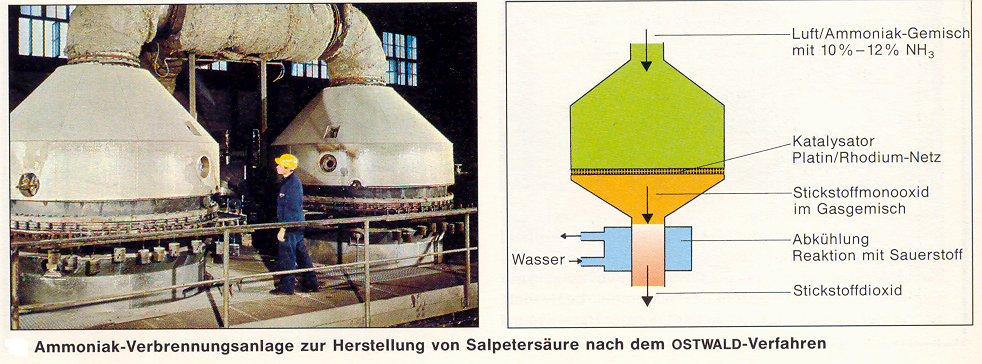
Heute wird noch ein Großteil des nach dem Haber-Bosch-Verfahren synthetisierten Ammoniaks für die Herstellung von Salpetersäure verbrannt. Dazu lässt man nach dem schon erwähnten Vorschlag von Wilhelm Ostwald ein Ammoniak- Luft- Gemisch mit großer Geschwindigkeit durch ein Platinnetz als Katalysator strömen (bei 800 °C) und das gewonnene Stickstoffoxid NO wird mit Luft und Wasser zu Salpetersäure umgesetzt.
Die Reaktionen zur Salpetersäureherstellung laufen also folgendermaßen ab:
1.
(Herstellung Ammoniak): N2
+ 3 H2 ![]() 2 NH3
2 NH3
2.
(Herstellung Stickstoffoxid): 4 NH3
+ 5 O2 ![]() 4 NO + 6 H2O (NO reagiert mit Luft zu NO2
)
4 NO + 6 H2O (NO reagiert mit Luft zu NO2
)
3.
(Herstellung Salpetersäure): 4 NO2 + 2 H2O
![]() 4 HNO3
4 HNO3
Diese Reaktionen erfordern besondere prozentuale Zusammensetzungen, damit Salpetersäure entstehen kann.
Heutige moderne Salpetersäure-Anlagen stellen täglich etwa 1200 Tonnen Säure her. Sie müssen insgesamt nur vier mal im Jahr abgeschaltet werden, damit das Platin- Netz ausgetauscht werden kann.
(Quellen 1, 2, 3 und 6)
Bild von einer heutigen und damaligen Salpetersäuren-Anlage :
Der erste Weltkrieg und der „Salpetermangel“:
War das ursprüngliche Arbeitsziel die Herstellung von Düngemitteln, so wurde die weitere Entwicklung durch die Vorkriegszeit und die Kriegsereignisse selbst in andere Bahnen gelenkt. Man hatte längst erkannt, dass man mit Salpetersäure Explosivstoffe aller Art herstellen kann und so wurde dieser Stoff für die Munitionsversorgung im Krieg unentbehrlich.
Der Ausbruch und Verlauf der ersten Weltkrieges veranlaßte Deutschland nicht nur Sprengstoff herzustellen, sondern auch die Rüstungsforschung anzutreiben um noch gefährlichere Munition zu entwickeln.
Auch Fritz, Direktor des Kaiser-Wilhelm-Instituts für physikalische Chemie, der schon wie erwähnt mit Carl Bosch die Ammoniaksynthese entwickelt hatte, trug selbst zur Forschung bei, indem er sich für die Entwicklung und Produktion von Giftgas einsetzte. Er war jedoch nur einer von Tausenden deutschen Chemikern, die an der Entwicklung von Giftgas und anderen chemischen Kampfstoffen beteiligt waren.
Der Verlauf des Krieges erforderte jedoch immer mehr neu entwickelte Waffen höchster Qualität, denn nicht nur Deutschland investierte viel Kapital in die Rüstungsforschung und Aufrüstung, auch Großbritannien entwickelte neue Waffen. So wurde das Unternehmen BASF, welches im Herbst 1913 in Oppau die erste Fabrik eröffnete, in der Stickstoff nach dem Haber-Bosch-Verfahren aus Luft gewonnen wurde, eines der größten Unternehmen in der chemischen Industrie weltweit und hatte im ersten Weltkrieg keinen Konkurrenten zu fürchten.
Vor lauter Rüstungsforschung wurde jedoch ein Problem fast übersehen. Deutschland hatte auf lange Sicht zu wenig Vorrat an Salpeter.
Als im Herbst 1914 die deutsche Heeresleitung nach der verlorenen Marneschlacht erkannte, dass ein „Blitzkrieg" nicht möglich war und folglich mit einem langen Krieg zu rechnen war, erfasste die Heeresleitung Panikstimmung: Durch die Blockade der Alliierten war Deutschland von der Zufuhr chilenischen Salpeters weitgehend abgeschnitten. Es war die erste erfolgreiche Kriegsaktion der Alliierten und man stellte entsetzt fest, dass angesichts der geringen Salpetervorräte die Munitionsversorgung der Truppe ernsthaft in Frage gestellt war. Erst allmählich machten sich die deutschen Offiziere bewusst, dass der Krieg keine drei Monate dauern könnte, bis alles verloren wäre.
Carl Duisberg schildert diese Situation und die Rolle der Chemie:
„Es
fehlte der für Pulver und Sprengstoff durchaus unentbehrliche
Rohstoff, der nur aus dem Auslande zu beziehende Salpeter. Schon im
Herbst 1914 hatte die Sprengstoffindustrie davon nichts mehr. Hätte
die chemische Industrie und besonders die Farbenindustrie und daneben
die Landwirtschaft nicht große Vorräte an Salpeter gehabt,
so wäre der Krieg schon Ende 1914 zu Ende gewesen. Aber auch
diese Vorräte der chemischen Industrie und der Landwirtschaft,
von denen wiederum das Kriegsministerium keine Ahnung hatte, und um
die es sich vorher nicht im mindesten gekümmert und bemüht
hatte, sie reichten nur bis Mitte 1915, dann waren wir ganz am
Schluss, dann waren wir endgültig verloren. Da haben die
deutschen Chemiker eingegriffen; sie haben alles daran gesetzt, was
sie konnten, um diesen frühzeitigen Zusammenbruch zu verhindern"
(Flechtner, 1959, S. 270).
Da die Vorräte an Salpeter immer geringer wurden musste man an der Front, obwohl dies dem Sinn von „ritterlicher Kriegführung“ widersprach, mit dem entwickelten Giftgas weiter kämpfen. So war es ein großes Glück, dass das deutsche Heer im eroberten Rotterdamer Hafen Lagerhäuser mit Chile- Salpeter besetzen konnte.
Doch man musste trotzdem auf irgendeine Weise Sprengmittel herstellen können um nicht in naher Zukunft kapitulieren zu müssen.
Im
September 1914, einige Wochen nach Kriegsbeginn, wurde Carl Bosch zu
einer Besprechung über die Munitionsfrage ins Kriegsministerium
nach Berlin gerufen und nach einer Situationsbesprechung stellte er
an seinem Mitarbeiter Alwin Mittasch (1869-1953) die Frage, ob eine
Salpetersäureherstellung in großem Maße ohne
Platinkontakte in seinen Möglichkeiten läge. Mittasch
bejahte diese Frage, und Bosch konnte nun sein bekanntes
„Salpeterversprechen" an die Oberste Deutsche
Heeresleitung geben.
Im ersten Versuchsbetrieb mit dem als
„Braunoxid-Kontakt" bezeichneten neuen Katalysator
arbeitete man dann bereits Weihnachten 1914, und im Mai des folgenden
Jahres lief die Großproduktion mit einer damals beträchtlichen
Tageskapazität von 150 t Salpetersäure an. Die für die
„Ammoniakverbrennung" eingesetzten Kontaktöfen
bestanden aus zylindrischen, innen ausgemauerten Behältern von
etwa 5 m Höhe und besaßen im Innern eine gelochte
Steinplatte, auf der sich die Kontaktmasse befand. Luft und
Ammoniakgas wurden im richtigen Verhältnis gemischt, auf 250 bis
350 °C vorgeheizt und dann in den Kontaktofen eingeblasen, wo die
Reaktion stattfand. Der Ofen wurde dabei von oben nach unten
durchströmt. Die abströmenden heißen Gase wurden
gekühlt und in die Absorptionsanlagen geschickt. Auf diese Weise
gelangte man zur Salpetersäure.
Doch trotz dieses neuen Verfahrens, welches die Versorgung des deutschen Heeres mit Munition sicherstellte, verlor das Deutsche Reich den Krieg bekanntlich.
Nach der Kapitulation stellte sich eine weitere Frage an die Siegermächte:
„Wie weit hatten die Fabriken zur Herstellung von Düngemittel und wie weit zur Herstellung von Sprengstoffen gedient?“
Die Antwort war eigentlich eindeutig, wenn man die Fakten zu Grunde legt, wie viele Menschen in der Kriegszeit hungern mussten.
Die Franzosen wollten folglich unbedingt sowohl alle Lagerorte chemischer Stoffe (vor allem die „Nitratstandorte“) als auch viele Farbenfabriken schließen. Obwohl sich Carl Bosch, als neuer deutscher Unterhändler der chemischen Industrie, Forderungen von Inspektoren, die die Fabrik in Oppau bei laufendem Betrieb begutachten wollten, widersetzte, war es abzusehen, dass vor allem die chemische Industrie im Deutschen Reich sehr stark „eingeengt“ werden würde.
Schließlich wurde im Artikel 306 des Versailler Vertrages festgeschrieben, dass alle Patente nicht mehr zurückzuerstatten seien und alle Fabriken, die der „Herstellung, Vorbereitung, Lagerung oder zur Konstruktion von Waffen, Munition oder irgendwelchem Kriegsmaterial“ dienten, geschlossen werden müssten.
So wurden viele Fabriken, die Giftgas, Nitrate oder Salpetersäure hergestellt hatten, von Franzosen und Engländern demontiert.
(Quellen 1, 2, 3, 4 und 5)
Bilder von Kriegsschauplätzen :
Schlacht von Passchendaele Mörsereinsatz im Ersten
Weltkrieg

Vorwurf an die chemische Industrie?
Da der schreckliche Krieg vorbei war, wurde zur damaligen Zeit häufig der Vorwurf laut, dass erst durch die chemische Industrie die Kriegführung besonders mit schrecklichen Kampfgasen bis zum Zusammenbruch 1918 ermöglicht wurde und die Skrupellosigkeit dieses Industriezweiges sich hier besonders deutlich zeige. Besonders stellte sich in diesem Zusammenhang die Frage nach der Verantwortung des Wissenschaftlers im Kriegsfall.
Es fehlte einerseits nicht an Beispielen, die die Kriegsbegeisterung von Wissenschaftlern zeigten. So sagte einst der deutsche Nationalökonom Sombart:
„Der
Krieg, so schien es, verlieh auch der Technik einen neuen Sinn,[...]
Die 42-cm-Mörser [...], die bombenwerfenden Flugapparate, die
Unterseeboote haben uns wieder einen Sinn des technischen
Fortschrittes offenbart[...] ." (Schwabe, 1969, S. 39).
Eines ist jedoch heutzutage nicht abzustreiten:
Sowohl früher als auch heute war und ist technischer und wissenschaftlicher Fortschritt unaufhaltsam. Aber es ist immer möglich, dass wenn neue Erfindungen in die falschen Hände geraten, sie für schlimme Zwecke missbraucht werden und nicht das ursprüngliche Ziel, nämlich dem Menschen seinen Alltag zu erleichtern, erreichen. Denn schon als die Axt vor vielen Jahrhunderten „erfunden“ wurde, merkte der Mensch, dass man diese neue Erfindung nicht nur zum Bäume fällen, sondern auch als Mordwaffe „gebrauchen“ konnte.
So steht der Wissenschaftler, besonders der Chemiker und Biologe, heute in einer Zwickmühle, denn er weiß, dass seine Erkenntnisse auch einmal missbraucht werden können und Wissenschaft auch Risiko bedeutet. Doch er muss aus politischen und wirtschaftlichen Gründen, da Fortschritt oft Ansehen und Geld bedeutet, weiter an der genstruktur des Menschen oder an neuen un wirkungsvolleren Kriegswaffen forschen.
Und trotzdem wird sich in naher Zukunft die entscheidende Frage stellen:
Wie weit dar Wissenschaft noch gehen?
Es wird nicht einfachsein, darauf eine eindeutige Antwort zu finden ...
(Quellen 1; 3 und 4)
Quellenverzeichnis:
1: www.hamm-chemie.de/j11/j11te/salpetersaeure_geschichte.htm
2: www.erich-schairer.de/maa/kap033.html
3: Goetze-Fischer, Anorganische und allgemeine Chemie, C.C. Buchner-Verlag, 1982, S.240-242
4: http://www.wienerzeitung.at (Brot und Sprengstoff – ein chemisches Verfahren und die Folgen der
Zwischenkriegszeit)
5: Propyläen Technik Geschichte 1840 - 1914, Ullstein Verlag,1997, S.180, 384-7
6: Chemie-Lehrbuch „Stoff – Formel - Umwelt“, C.C. Buchner, Seite 97
Ammoniak und seine Bedeutung in der Kriegswirtschaft
von Sabrina Hurschmann
Der erste Weltkrieg machte in Deutschland die Intensivierung der Rüstungsforschung notwendig, wobei das Hauptaugenmerk auf der Ammoniaksynthese lag. Der gewonnene Ammoniak war wichtig für die Salpetersäureherstellung. Während des Krieges waren Tausende Techniker und Chemiker damit beschäftigt, Herstellungsverfahren für die bei der Herstellung von Sprengstoffen nötige, Salpetersäure zu optimieren.
Früher wurde Salpetersäure durch das Einwirken konzentrierter Schwefelsäure auf importierten Salpeter (meist aus Chile) gewonnen. Doch da Deutschland während der Kriegszeit von den Lieferungen aus Chile komplett abgeschnitten war, benötigte man andere Möglichkeiten der Salpetersäureherstellung.
Das Haber-Bosch-Verfahren, das zunächst für die Herstellung von Düngemitteln vorgesehen war, wurde im Krieg für die Sprengstoffherstellung genutzt. Durch dieses Verfahren war es möglich, bei hohem Druck und hohen Temperaturen mit einem Osmium-Katalysator Wasserstoff und Luftstickstoffzu Ammoniak zu verbinden. Dies löste das Ammoniak-Problem.
Das nächste Problem, dass sich stellte, war die Herstellung von Salpetersäure aus Ammoniak: Zwar war seit 1838 bekannt, dass Ammoniak an einem Platinkontakt zu einer Vorstufe der Salpetersäure (Stickoxid [NO]) oxidiert, aber diese Erkenntnisse waren in Vergessenheit geraten. Da Platin ein sehr teures Material war, suchte man nach einer billigeren Kontaktmasse. Bereits Ende 1914 gelang ein Versuch der Ammoniakverbrennung an einem so genannten „Braunoxid-Kontakt", der die folgende Reaktion unterstützte:
Verbrennung von Ammoniak
1.)
4 NH3 + 3 O2
![]() 2 N2 + 6 H2O
2 N2 + 6 H2O
2.)
4 NH3 + 5 O2
![]() 4 NO + 6 H2O
4 NO + 6 H2O
Da NO als Vorstufe der Salpetersäure zur Weiterverarbeitung eingesetzt werden soll, ist 2. Reaktion für die Herstellung der Salpetersäure günstiger. Da der geforderte Sauerstoffüberschuss die Gefahr der Explosion birgt, ist ein Mischungsverhältnis von Luft + 12% Ammoniak optimal. So verbrennen bis zu 98% des Ammoniaks zu NO. Da NO mit Luft zu NO2 reagiert, ist das eigentliche Endprodukt der Reaktion NO2. NO2 lässt sich zu Salpetersäure weiterverarbeiten:
4
NO2 + 2 H2O + O2
![]() 4 HNO3
4 HNO3
Womit die Herstellung der für das Militär als Ausgangsstoff der Sprengstoffe wichtigen, Salpetersäure aus Ammoniak abgeschlossen ist.
Bereits im Mai 1915 sicherte der Beginn der Großproduktion von Salpetersäure an „Braunoxid-Kontakten" die Versorgung des Militärs mit Munition.
Eine weitere Nutzung im Krieg war das Giftgas:
Giftgas wurde ab 1915 entwickelt und produziert. Es war dazu gedacht, feindliche Soldaten aus den Schützengräben zu treiben, hatte aber sonst nur geringen militärischen Nutzen. Deshalb lehnten viele Militärs den Gebrauch von Giftgas ab. Weiter Gründe für die gespaltenen Meinungen zu Giftgas waren, dass es nicht der typischen Kriegsführung entsprach und großen Hass auf die deutschen Truppen hervorrief. Trotzdem wurde es im ersten Weltkrieg häufig verwendet um das Fehlen von Spreng- und Schießpulver an der Front zu kompensieren.
Quellen :
Wiener Zeitung (erschienen am 22.03.2002)
Propyläen, Technik Geschichte 1840 - 1914, Ullstein Verlag, 1997, S. 180,384 - 7
www.hamm-chemie.de/j11/j11te/salpetersaeure Qeschichte.htm
Goetze-Fischer, Anorganische und allgemeine Chemie, C.C. Buchner-Verlag, 1982, S. 240-242
Die Verantwortung des Wissenschaftlers bei der Anwendung von Forschungsergebnissen
Der folgende Text handelt von der Verantwortung und Gefahren mit denen ein Wissenschaftler konfrontiert wird, wenn er neue Sachen erfindet. Dies wird am Beispiel von Fritz Haber sehr deutlich.
Schon seit je her hat der Mensch den Drang gehabt neue Sache zu erfinden und bestehende Sachen weiter zu entwickeln. Doch wurden und werden zum Teil heute noch die meisten Sachen, die die Wissenschaft entwickelt auf kurz oder lang in den Dienst des Krieges gestellt. Zum Beispiel das Beil, es war auf der einen Seite ein Arbeitsgerät, dass die Arbeit sehr vereinfachte und auf der anderen Seite eine Mordwaffe, die zum Morden und Krieg führen genutzt wurde. Die Wissenschaft ist ein zweischneidiges Schwert. Fritz Haber erfand das Haber-Bosch Verfahren womit Ammoniak viel schneller produziert werden konnte. Jedoch wurde dies schon schnell verwandt, um den Bedarf an Ammoniak für die Munitionsherstellung im ersten Weltkrieg zu decken. Später stellte Haber seine Fähigkeiten ohne Bedenken in den Dienst des Kriegsministerium, so trieb er die Entwicklung des Giftgases deutlich voran, um so die drohende Niederlage im ersten Weltkrieg abzuwenden. Es wurde am 22.4.1915 bei Ypern zum ersten Mal französische Truppen durch Chlorgasschwaden zum Rückzug gezwungen. Dies hatte nicht nur zur Folge, dass über 5.000 Soldaten qualvoll starben, sondern auch seine Frau, die Chemikerin Dr. Clara Haber, beging Selbstmord mit der Dienstwaffe ihres Mannes, weil sie nicht mit der Verantwortung leben konnte, die ihr Mann auf sich und so auch auf sie geladen hatte. Eher gleichgültig fuhr er an dem gleichen Abend noch zurück an die Front. Später war er auch verantwortlich für die Einführung der Grünkreuz-(Phosgen) und Blaukreuzgeschosse (Chlor-Arsen-Kampfstoffe). Sie kamen allerdings nicht mehr zum Einsatz. Insgesamt starben ungefähr 91.000 Soldaten an Giftgas und 1,3 Millionen Menschen wurden verletzt. Es wird auch vermutet, dass Fritz Haber an der Entwicklung des Gases für die Konzentrationslager gearbeitet hat, wodurch dann Millionen Juden vergast worden sind. Es ist paradox, dass ein Jude für die beinahe Vernichtung seines Volkes verantwortlich war. Heute besteht die Gefahr durch Atomwaffen oder auch durch gezüchtete Viren und Bakterien, aber auch durch falschen Umgang mit der Gentechnik. Es ist eine große Aufgabe und auch eine schwere Last für die Wissenschaftler nicht missbraucht zu werden, und trotzdem, dass die meisten entwickelten Nationen in Frieden miteinander leben, ist die Verantwortung des Wissenschaftlers nicht gerade weniger geworden. Gerade in demokratischen Gesellschaften, die sich ein friedliches Zusammenleben auf der Erde zum Ziel gesetzt haben, ist es wichtig, dass Wissenschaftler selbständig und verantwortungsbewusst arbeiten. Sie müssen darauf achten, dass ihr wissen nicht in falsche Hände gerät, wie zum Beispiel von Regierungen.
Quellen:
1. Unterrichtsinhalte Chemie, Starke Verlag (Biografie Fritz Haber)
2. Film: „ Verantwortung der Wissenschaft“
3. Eduthek: http://www.ph-freiburg.de/Projekt-ILL/Frauen/immerwahr/clara_immerwahr.htm#Giftgas
Die Verantwortung des Wissenschaftlers bei der Anwendung von Forschungsergebnissen
von Gerhard Guist
Die Anwendung von Forschungsergebnissen und die damit verbundene Verantwortung des Wissenschaftler, lässt sich sehr gut an dem Wissenschaftler Fritz Haber verdeutlichen. Er war der Chemiker dem die direkte Gewinnung von Stickstoff aus der Luft durch die Ammoniak-Synthese gelang. Die Ammoniak-Synthese konnte industriell verwertet werden und man sah darin ein überaus wichtiges Mittel zur Hebung der Landwirtschaft und der Lösung des Welt-Hungers Problem.
Das Verfahren der Ammoniak-Synthese stand aber auch in der Herstellung des Salpeters im Vordergrund, denn Salpeter war für die Produktion von Sprengmitteln unerlässlich.
 Fritz
Haber engagierte sich nach der Entwicklung der Ammoniak-Synthese,
stark für die deutsche Rüstungsindustrie im 1. Weltkrieg
und so unterschrieb er mit 92 anderen Wissenschaftlern den „Appell
an die Kulturwelt“.
Fritz
Haber engagierte sich nach der Entwicklung der Ammoniak-Synthese,
stark für die deutsche Rüstungsindustrie im 1. Weltkrieg
und so unterschrieb er mit 92 anderen Wissenschaftlern den „Appell
an die Kulturwelt“.
Seine Frau Clara Immerwahr konnte nur noch mit ansehen, wie das streben nach Macht ihren Mann komplett veränderte.
Das deutsche Militär wusste trotz der anfänglichen Erfolge, das kein schneller deutscher Sieg zu erwarten war und so wurde ausgiebig nach einer effektiven Waffe gesucht, welche die Feinde aus den Schützengräben treiben und dauerhaft schädigen sollte. Fritz Haber begann nach diesem Auftrag sofort mit den Experimenten und war auch nach der Suche nach Giften. In seinem Institut gelang ihm die Begasung von Tieren mit Chlorgas. Es war nicht mehr menschlich mit welcher Akribie er versuchte die systematische Vernichtung von Leben zu erproben. Lediglich seine Frau war empört und erschüttert das dabei niemand auf die Idee kam, diese Aktionen moralisch zu hinterfragen. Sie bezeichnete die Entwicklung von Chlorgas als ein „Zeichen der Barbarei“.
Am 22. April kam es dann letztendlich zum ersten Einsatz im “großen Maßstab“ von Chlorgaswaffen bei Ypern in Nordfrankreich. Fritz Haber organisierte den ersten großen Einsatz mit den Chlorflaschen, welche eine Gaswolke von 6 km Länge und 600 bis 900 m Tiefe ablasen. Hier zeigte sich auch das schreckliche Bild dieser Waffe. Die französischen Divisionen wurden überwältigt und ca. 18.000 französische Soldaten getötet. Das Chlorgas tötete langsam und grausam, die Männer hatten Schaum vor den Lippen und wurden von Brechreiz geschüttelt. In Deutschland wurde Fritz Haber als Kriegsheld empfangen und wurde mit diesem „Erfolg“ zum Hauptmann befördert. Nach den Feierlichkeiten zur Ernennung zum Hauptmann machte Haber seiner Frau Vorwürfe sie wäre ihm und Deutschland durch Gespräche mit anderen Wissenschaftlern über die Gasangriffe in tiefster Not in den Rücken gefallen. In der Nacht tötete sich Clara mit der Dienstpistole ihres Mannes selbst. Noch am Abend des Todestages reiste Fritz Haber planmäßig an die Ostfront.
Insgesamt wurden durch Giftgasangriffe im 1. Weltkrieg 91.000 Soldaten getötet und 1,3 Millionen Menschen wurden durch Giftgas verletzt. Ich denke diese durchaus erschreckenden Zahlen verdeutlichen, welch große Verantwortung Wissenschaftler überhaupt haben. Die Wissenschaftler und Chemiker haben die Verantwortung auf die Gefahren der modernen Technik aufmerksam zu machen und verantwortungsbewusst mit Forschungsergebnissen umzugehen und sich nicht für die Kriegsführung “benutzen zu lassen“.
Quellen:
Unterrichtsmaterialien Chemie, Stark Verlag, Berühmte Chemiker
Chemie heute SII, M. Jäckel, Schroedel-Verlag, 1988, S.110
Propyläen Technik Geschichte 1840 - 1914, Ullstein Verlag,1997, S.180, 384-7
Ammoniak – chemische und physikalische Eigenschaften
von Katharina Przibilla
Im folgenden Text werde ich die physikalischen, als auch die chemischen Eigenschaften von Ammoniak zusammenfassen und darstellen.
Ammoniak hat die Formel NH3 und ist somit eine Verbindung aus einem Stickstoff- und drei Wasserstoffatomen. Diese Verbindung ist farblos und bei Zimmertemperatur gasförmig. Erkennen kann man das Ammoniakgas an seinem beißenden und stechenden Geruch. Außerdem kann es zu Augenreizungen und Hornhautverätzungen führen.1
Ammoniak ist bei Zimmertemperatur gasförmig. Durch bestimmte Gegebenheiten kann Ammoniak aber leicht zu einer farblosen, leicht beweglichen Flüssigkeit verdichtet werden. Diese Flüssigkeit besitzt einen geringen Siedepunkt, der bei –33,4°C liegt. Bei einer Temperatur von -77,7°C verhärtet sich die Flüssigkeit und bildet weiße, transparente Kristalle.
Ammoniak ist sehr gut in Wasser löslich. In einem Liter Wasser können sich etwa 520g Ammoniak lösen. Diese Lösung wird Salmiakgeist genannt. Aufgrund dieser Eigenschaft gelangt Ammoniak zumeist als Salmiakgeist in den Handel, da Ammoniak mit Sauerstoff zu einem explosiven Gemisch wird und in der gelösten Form das Explosionsrisiko nicht vorhanden ist. Salmiakgeist hat alkalische Eigenschaften. Das liegt daran, dass Ammoniak (NH3) ein partiell positiv geladenes H-Atom des Wassers aufnehmen kann, da es ein freies Elektronenpaar am Stickstoffatom besitzt, welches als Base fungiert. Durch die Aufnahme von H+ wird NH3 zu NH4+. Zurück bleiben die OH-Ionen, welche für die alkalische Wirkung verantwortlich sind.
Ammoniak ist als Lösungsmittel für viele Stoffe, wie zum Beispiel Salze, geeignet und ähnelt in seinen Eigenschaften als Lösungsmittel Wasser. Salze werden beim Lösen in Ammoniak in Ionen gespalten, was bei Wasser ebenfalls der Fall ist.
Wird Ammoniak unter Mitwirken eines Katalysators erwärmt, zerfällt es in seine Bestandteile Wasserstoff und Stickstoff, bis das Gleichgewicht eingestellt ist.
2NH3
+ Energie
![]() N2 + 3H2
N2 + 3H2
Das sich ein Gleichgewicht einstellt bedeutet, dass genauso viel Ammoniak gebildet wird, wie gleichzeitig wieder zerfällt.
Ammoniak kann an der Luft entzündet werden. Es brennt jedoch nicht weiter. Nur unter zutun von Katalysatoren brennt Ammoniak zusammen mit Luft oder Sauerstoff. Dies funktioniert mit einem Katalysator bereits bei Temperaturen von 300°C bis 500°C. Bei dieser Verbrennung entstehen Stickoxide, die zur Salpetersäuregewinnung benötigt werden. Bei einer Verbrennung von Ammoniak ohne Katalysator, also bei deutlich höheren Temperaturen (Zündtemperatur bei 630°C), verbrennt Ammoniak zu Wasser und Stickstoff. Für diese Verbrennung ist eine fahlgelbe Flamme typisch.2;3
Beim experimentieren mit Ammoniak sollte man darauf achten, dass man Gemische mit Ammoniak immer vor dem Versuch neu herstellt, da bei längerer Aufbewahrung das Explosionsrisiko zunimmt.
Aufgrund seiner vielfältigen Eigenschaften wird Ammoniak in vielen Bereichen benötigt. Unter anderem in der Landwirtschaft und in der Rüstungsindustrie.
Quellen :
1. M. Jäckel u.a., Chemie heute SI, Schroedel-Verlag, 1993, S.239,246
2. Hollemann – Wiberg, Lehrbuch der anorganischen Chemie – deGruyter-Verlag, 1971, S.335ff.
3. Unterrichtsmaterialien Chemie, Stark Verlag, Stoffe
Ammoniak – chemische und physikalische Eigenschaften
von Christian Kühr
Ammoniak (Def.):
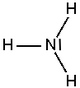
Ammoniak (NH3) ist ein äußerst stark stechend riechendes, farbloses Gas, das zu Tränen reizt und erstickend wirkt.
Physikalische Eigenschaften:
Ammoniak ist entsprechend seiner molaren Masse (17,03 g/mol) wesentlich leichter als Luft (29 g/mol). Die Dichte des Ammoniak beträgt 0,77 g/L (im Vergleich dazu p(Luft) = 1,29 g/L). Die Besonderheit ist, dass sich Ammoniak leicht zu einer farblosen, leichtbeweglichen, stark lichtbrechenden Flüssigkeit verdichten lässt, welche bei –33,43°C siedet und bei –77,76°C zu weißen, durchscheinenden Kristallen erstarrt. Die Wasserlöslichkeit des Ammoniaks ist sehr gut (520 g/L bei 20°C). Die Lösung reagiert alkalisch, weil Ammoniak-Moleküle ein Proton vom Wasser aufnehmen können, sodass Hydroxid-Ionen zurückbleiben. Außerdem ist die polare Lösung (Salmiakgeist) schwach basisch. Flüssiges Ammoniak ist ein gutes Lösungsmittel für z.B. Salze.
Chemische Eigenschaften:
Ammoniak ist bei gewöhnlicher Temperatur beständig, zerfällt jedoch beim Erwärmen in Gegenwart von Katalysatoren in Umkehrung der Synthesegleichung bis zum Gleichgewichtszustand in seine Elemente:
2
NH3
![]() 3 H2 + N2 exotherme Reaktion
3 H2 + N2 exotherme Reaktion
- Die Reaktion verlagert sich bei steigendem Druck nach rechts.
- Die Reaktion verlagert sich mit fallender Temperatur nach rechts.
Der Stickstoff des Ammoniak ist drei- oder fünfwertig. In wässriger Ammoniaklösung ist er fünfwertig, wobei der Übergang der einen Bindung in die andere vollständig reversibel ist. Infolgedessen lässt sich Ammoniak aus Wasser restlos austreiben. Der größte Teil des Ammoniaks ist im Wasser einfach gelöst und nur ein kleiner Teil als Ammoniumhydroxid an das Wasser gebunden:
NH3
+ H2O
![]() NH4+ + OH-
NH4+ + OH-
An der Luft lässt sich Ammoniak zwar entzünden, brennt aber nicht weiter. In Gegenwart von Katalysatoren kann die Verbrennung von Ammoniak-Luft- und Ammoniak-Sauerstoff-Gemischen schon bei 300 bis 500°C erreicht werden. Die Folge sind Stickoxide:
4
NH3 + 5 O2
![]() 4 NO + 6 H2O (g)
4 NO + 6 H2O (g)
Ohne KAT (höhere Temp.) verbrennt Ammoniak in reinem Sauerstoff mit fahlgelber Flamme zu Stickstoff und Wasser:
4
NH3 + 3 O2
![]() 2 N2 + 6 H2O (g)
2 N2 + 6 H2O (g)
Bei hohem Druck sind solche Ammoniak-Sauerstoff-Gemische explosibel.
Quellen :
M. Jäckel u.a., Chemie heute SI, Schroedel-Verlag, 1993, S.239,246
Hollemann – Wiberg, Lehrbuch der anorganischen Chemie – de Gruyter-Verlag, 1971,S.335ff.
Unterrichtsmaterialien Chemie, Stark Verlag, Stoffe
Biographie: Fritz Haber
von Lisa Schmid
Fritz Haber wurde am 20. Dezember 1868 als Kind eines angesehenen Kaufmanns und Besitzer einer
Farben- und Chemikalienhandlung und seiner Frau in Breslau geboren. Die Mutter starb jedoch schon
bald nach seiner Geburt.
Nach der Grundschule besuchte er ein humanistisches Gymnasium. Mit 18 Jahren begann er in Berlin
Chemie zu studieren. Nach 10 Jahren, in denen er auch ein Zwischensemester bei BUNSEN in Hei-delberg absolvierte, schloss er das Studium mit Promotion ab.
Danach arbeitete er zunächst bei einer Spiritus- und Melassefabrik in Budapest, danach bei der ersten
österreichischen Amoniaksoda-Fabrik in Scakowa, dann in der Zellstofffabrik Feldmühle.
Nach diesen ersten Berufserfahrungen absolvierte er ein weiteres Semester an der Hochschule in Zürich in anorganischer Technologie und kam schließlich zur Physikalischen Chemie, für die er sehr begabt war.
1893 konvertierte er von jüdischen zum christlich-protestantischen Glauben.
1894 erhielt er eine Assistentenstelle bei BUNTE im chemisch-technischen Institut in Kar1sruhe, wo er
17 Jahre blieb. Er forschte unter anderem an der Bunsenflamme und der Reaktionskinetik von Gasen unter extremen Reaktionsbedingungen.
Im August 1901 heiratete Fritz Haber die Doktorin der Chemie Clara Immerwahr. Der gemeinsame Sohn Hermann kam am 1. 6. 1902 zur Welt.
Seine Frau war ihm auch in beruflicher Sicht eine große Hilfe, da sie ihn vor allem anfänglich bei seinen Forschungen unterstützte und oft sein Labor sowie seine Lehrveranstaltungen besuchte.
1906 wurde er ordentlicher Professor für physikalische Chemie an der Technischen Hochschule Karls-
ruhe. Er war ein sehr guter Lehrer und Erklärer und konnte selbst die komplexesten Vorgänge einfach und verständlich darstellen.
Doch er war auch weiterhin in der Forschung tätig. Als um die Jahrhundertwende absehbar wurde, dass die Vorräte an Chilesalpeter, der in der Landwirtschaft als künstlicher Dünger immer unentbehrlicher wurde, den gesamten dortigen Bedarf nicht würde decken können, begann man sich in der Forschung nach anderen Möglichkeiten der Salpetergewinnung umzusehen. Als eine Möglichkeit dazu sah man die Verarbeitung von Luftstickstoff in Ammoniak, woraus Salpetersäure gewonnen werden kann. So begann Haber, den diese Aufgabe reizte, zunächst mit der Forschung an der Oxidation des Stickstoffs im elektrischen Bogen. Dann forschte er an der Ammoniaksynthese aus Stickstoff und Wasserstoff. Doch er war nicht der einzige, der sich mit diesem Problem auseinandersetzte: Auch Professor Nernst forschte an der Ammoniaksynthese und fand heraus, dass das Gleichgewicht der Reaktion bei einem Druck von 70 bar weit auf der Eduktseite lag; ein Ergebnis, dass später widerlegt wurde. Gemeinsame Untersuchungen von Haber, van Ordt und Le Rossignol ergaben, dass die Ausbeute von Ammoniak bei diesen Verhältnissen doppelt so hoch waren, wie Nernst annahm.
Doch diese Mengen Ammoniak, die bis dato hergestellt werden konnten, waren für eine technische Synthese noch viel zu gering, also galt die Suche einem aktiveren Katalysator und einer technischen Apparatur, die es erlaubte, den gebildeten Ammoniak flüssig vom übrigen Gas zu trennen und aufzufangen, und so die nicht umgesetzten Edukte erneut der Synthese zu unterziehen. Als bester Katalysator fand sich Osmium, der auch bei einer Temperatur von 600 °C noch wirksam genug war.
Am 2. 7. 1909 war es dann endlich soweit: Die Syntheseapparatur wurde den Herren Bosch und Mittasch von der BASF vorgeführt. Der Versuchte klappte zwar erst beim zweiten Mal, doch er war überzeugend. Bosch entwickelte diesen Demonstrationsversuch zum technischen Großverfahren, Mittasch die nötigen Katalysatoren. Die wesentlichen Merkmale Habers Modellapparatur blieben jedoch erhalten.
Die Entwicklung der Ammoniaksynthese spielte für die technische Industrie eine äußerst bedeutsame Rolle, denn das Verfahren hat praktisch keine Rohstoffprobleme und ist sehr effektiv. Heute beträgt die Jahresproduktion an Ammoniak allein in Deutschland 1 787 000 t. Die Ernährung der Menschen ist
von diesem Verfahren abhängig geworden, da die Ammoniaksynthese die Düngung in der Landwirtschaft sicherstellt. Doch nicht immer war Ammoniak für friedliche Zwecke bestimmt.
Nach dieser grundlegenden Entwicklung wurde Fritz Haber im Jahre 1911 Leiter des Kaiser-Wilhelm-Instituts für Physikalische und Elektrochemie, heute bekannt als Max-Planck-Gesellschaft, in Berlin-Dahlem. Dort blieb er für 10 Jahre.
Als 1914 der 1. Weltkrieg ausbrach, ließ sich Haber von der allgemeinen Kriegsbegeisterung anstecken. Als Kriegsfreiwilliger wurde er Hauptmann und Abteilungsvorstand im preußischen Kriegsministerium. Zusammen mit 92 anderen Wissenschaftlern - darunter Max Planck, Wilhelm Röntgen und Ernst Haeckel - unterschrieb er den Appell "an die Kulturwelt", indem festgestellt wurde, dass allein der Materialismus die deutsche Kultur bis dato vor ihrem Untergang bewahrt habe.
Doch es zeigte sich, dass trotz anfänglicher militärischen Erfolge kein schneller Sieg des deutschen Reichs in Sicht war, denn der Krieg hatte sich zu einem Stellungskrieg entwickelt und es waren auf die
herkömmliche Art kaum Landgewinnungen zu machen. Also wurden deutsche Chemiker, darunter Fritz Haber, von Generalstabchef von Falkenhayn gebeten, nach Giften zu suchen, mit dem man den Feind aus den Schützengräben treiben und ihm dauerhaft schaden könnte.
Haber willigte ein und begann anhand von Tierversuchen die Wirkung von Chlorgas zu testen. Am 22.4. 1915 wurde das Gas zum ersten Mal bei Ypern in Nordfrankreich im großen Maßstab eingesetzt:
Es entstand eine Gaswolke von 6 km Länge und 600 bis 900 m Tiefe. Dabei kamen 18 000 französische Soldaten ums Leben und die französischen Divisionen wurden überwältigt. Jedoch trieb wegen einen Windwechsel ein Teil des Gases wieder zurück zu den deutschen Truppen, sodass es auch dort zahlreiche Todesopfer gab.
Die Ethik dieses Gaseinsatzes ist bis heute umstritten, doch Haber fand diese neue Waffe nicht inhumaner als viele andere Waffen auch.
Besonders seine Frau Clara Immerwahr kritisierte sein Vorgehen stark. Sie war sehr friedliebend und konnte den Einsatz ihres Mannes im und für den Krieg weder verstehen noch verarbeiten. Für sie war die Entwicklung des Giftgases "ein Zeichen der Barbarei, jene Disziplin korrumpierend, die dem Leben neue Einsichten vermitteln sollte".
Haber versuchte sie also vor Ort und Stelle von der Notwendigkeit der neuen Waffe zu überzeugen und nahm sie mit an die Front. Damit erreichte er jedoch nur das Gegenteil von dem, was er erreichen wollte, und seine Frau war nur noch entsetzter. Am 1. 5. 1915 nahm sie sich aus lauter Verzweiflung das Leben indem sie sich mit der Dienstwaffe Habers im Garten erschoss. Haber aber reiste noch am selben Abend wieder an die Front, weil er dort einen Termin hatte und erwähnt den Tod seiner Frau kaum.
Nach dem Krieg flüchtete Haber nach Schweden, denn die Alliierten verlangten seine Auslieferung. Doch die Vorbehalte ihm gegenüber lösten sich bald auf und er erhielt 1919 zusammen mit Bosch den
Nobelpreis für die Ammoniaksynthese.
Danach wollte Haber den Goldgehalt der Meere für die Goldproduktion nutzen, doch der Goldgehalt des Meeres war geringer als er angenommen hatte und die Aufarbeitung somit aussichtslos.
In der zweiten Hälfte der 20er Jahre verhalf er seinem Institut in Berlin-Dahlem (s.o.) zu internationalem Ansehen und gründete 1926 das Japan-Institut für deutsch-japanische Beziehungen in Berlin.
Außerdem war er an der Gründung der "Notgemeinschaft der deutschen Wissenschaft", aus der die heutige "Forschungsgemeinschaft hervorging, beteiligt.
Da Fritz Haber jüdischer Abstammung war, emigrierte er 1933 nach Cambridge, wohin er noch einen Ruf an die Universität erhalten hatte. Doch schon bald darauf, am 29. 1. 1934, erlag er auf der Durch-reise in Basel seinem Herzleiden.
Ironie des Schicksals: Das Giftgas, das Haber entwickelte, wurde im 2. Weltkrieg in Konzentrationslagern zur Vernichtung der Juden benutzt.
Die Nationalsozialisten schwiegen Haber wegen seiner jüdischen Herkunft tot und viele Gegner des dritten Reichs fanden ihn zu nationalistisch und zu "preußisch".
Quellen:
1. Unterrichtsmaterialien Chemie, Stark Verlag, Berühmte Chemiker (Fritz Haber, Clara Immerwahr)
Porträt - Fritz Haber
von Thomas Drulla

Fritz Haber
Fritz Haber, ein deutscher Chemiker und Pionier der chemischen Kriegsführung, wurde am 9. Dezember 1868 als Sohn einer jüdischen Kaufmannsfamilie in Breslau geboren und starb am 29. Januar 1934 schwerkrank auf einer Erholungsreise in Basel.
Er ging auf die St. Elisabeth Schule, wo er schon früh mit chemischen Experimenten begann. Nach Studien an den Universitäten in Heidelberg und Berlin erhielt er 1891 den Doktortitel in Organischer Chemie an der Technischen Hochschule Berlin-Charlottenburg. 1893 trat er vom jüdischen zum protestantisch-christlichen Glauben über. Anschließend arbeitete er an der ETH Zürich und in Jena, um seine Chemie-Ausbildung zu vervollständigen. 1894 wurde er in Karlsruhe zum Lehrbeauftragten, wo er 1898 zum außerordentlichen Professor für technische Chemie ernannt wurde. Schon 1904 begann Haber sich mit der katalytischen Bildung von Ammoniak zu beschäftigen. 1909 entwickelte er zusammen, mit Carl Bosch bei der BASF, einem weltbekannten Chemieunternehmen, die Ammoniaksynthese, auch Haber-Bosch-Verfahren genannt.
Carl Bosch
Er baute eine Pilotanlage, die einen Kilo Ammoniak pro Tag herstellen konnte. Stickstoff und Wasserstoff- der Luft und dem Wasserdampf entzogen- werden in Gegenwart eines Katalysators bei einer Temperatur von 550°C und unter Druck von mehr als 200 atü zusammengefügt. Dieses Verfahren ermöglichte die synthetische Herstellung von Ammoniak als Ersatz für Salpeter zur Herstellung von Düngemitteln und Sprengstoff.
Ab 1911 übernahm Fritz Haber die Leitung des Kaiser-Wilhelm-Instituts für Chemie und Elektrochemie in Berlin, das mittlerweile in Fritz-Haber-lnstitut umbenannt worden ist. Als der Erste Weltkrieg ausbrach, wurde er zum Berater der Deutschen Heeresführung und organisierte gegen den Willen seiner ersten Frau Clara Immerwahr Gasangriffe und -verteidigungen an der Kriegsfront. Nach Ende des Krieges bekam er 1918 den Nobelpreis für Chemie für die Ammoniaksynthese verliehen. 1919 versuchte er vergeblich sechs Jahre, aus dem Meer Gold zu gewinnen, um die deutschen Reparationen zu bezahlen. 1933 zwang ihn das Naziregime zum Rücktritt, als er sich weigerte, seine jüdischen Mitarbeiter zu entlassen. Er zog nach Cambridge, England, wo er allerdings nur ein Jahr blieb, da der englische Winter seine Herzbeschwerden verstärkte. Auf dem Weg nach Israel zum Daniel-Sieff-Institut starb er 1934 in der Schweiz.
Quellen:
www.wikipedia.com
Encarta- Lexikon
Brockhaus-Lexikon
Porträt: Clara Immerwahr
von Daniel Frick
Clara Immerwahr wurde am 21.Juni 1870 auf dem Landgut Polkendorf als jüngste Tochter von insgesamt vier Kindern von Dr. Philipp Immerwahr und Anna Immerwahr geboren. Ihr Vater war Chemiker und versuchte sich selbstständig zu machen, was ihm aber nicht gelang. Er war von jüdischer Herkunft und somit nicht angesehen in der Gesellschaft. Deshalb zog er aufs Land und trieb Landwirtschaft; dabei war er mit Hilfe von Kunstdünger erfolgreich.
Clara hatte ebenfalls mit ihrer jüdischen Abstammung zu kämpfen. Sie war eine interessierte und begeisterte Schülerin. Sie besuchte nur im Winter eine Schule, im Sommer wurde sie auf dem Hof ihres Vaters unterrichtet.1) Neben der Schule wurde sie „frei“ erzogen im Vergleich zur damaligen Zeit. Ihre Eltern wollten, dass auch ihre Töchter gebildet werden.2)
Aber 1890 starb Claras Mutter an Krebs und sie zog mit ihrem Vater nach Breslau, wo er eine neue Stelle als Direktor bekam. Clara hatte sich fest vorgenommen, einmal beruflich und wirtschaftlich auf eigenen Beinen zu stehen. Doch dazu musste sie auf ein Gymnasium. Aber Mädchen durften zu dieser Zeit nicht das Abitur erlangen. Also besuchte sie ein Lehrerinnenseminar, wo sie vor allem an naturwissenschaftlichen Fächern Interesse fand.1) Sie führte zahlreiche chemische Experimente zu Hause durch. In dieser Zeit bekam sie von der Schulvorsteherin Fräulein Knittel das Buch „Unterhaltungen über Chemie“ geschenkt. Durch dieses Buch wurde Claras Chemieinteresse geweckt.2)
Für Clara stand es fest, dass sie ein naturwissenschaftliches Studium absolvieren wollte. Doch als Mädchen durfte sie sich nicht offiziell immatrikulieren. Nach einiger Zeit wurde ihr es aber gestattet, zum Wintersemester 1896 die Vorlesungen gastweise an der Uni Breslau zu besuchen.1) In der Öffentlichkeit wurde sie verspottet, weil dieser Weg für eine Frau nicht normal war. Sie wurde auch von ihren Professoren und Mitstudenten verspottet.2) Clara besuchte die Laborvorlesungen mit Begeisterung und schreib schließlich ihre Doktorarbeit bei Professor Richard Abegg über das Thema: „Beiträge zur Löslichkeitsbestimmung schwerlöslicher Salze des Quecksilbers, Kupfers, Bleis, Cadmiums und Zinks.“1) Während ihrer Forschung fand sie heraus, dass die Potentialmessungen von Karl Friedrich Gauss kritisch hinterfragt werden mussten. Nun wurde zum ersten Mal ein Aufsatz von ihr über die „Potentiale von Kupfer-Elektroden in Lösungen wichtiger Kupfer-Niederschläge“ veröffentlicht.1)
Am 22. Dezember 1900 legte sie eine mündliche Prüfung in Chemie als Hauptfach und in Physik, Mineralogie und Philosophie als Nebenfächer ab. Nun war sie die erste Frau, die an der Uni Breslau den Doktortitel bekam – sogar mit dem Urteil „magna cum laude“. Clara war stolz darauf und kurze Zeit später wurde sie von einem Frauenverein gebeten, einen Vortrag über „Physik und Chemie im Haushalt“ zu halten, was sie auch tat.1)
Im April 1901 reiste sie mit ihrem Doktorvater Professor Abegg zu einem Kongress der deutschen Gesellschaft für Elektrochemie in Freiburg. Dort traf sie ihren Freund von den Tanzstunden, Fritz Haber. Als Clara eingesehen hatte, dass eine unverheiratete Frau in der Gesellschaft kein Ansehen hatte, ging sie auf den Heiratsantrag von Fritz Haber ein.2) Im August 1901 kam es dann zu der Hochzeit von Fritz Haber und Clara Immerwahr. Fritz Haber war ebenfalls Chemiker.
Am 1.6.1902 wurde ihr Sohn Hermann nach einer schweren Schwangerschaft geboren. Da Hermann sehr kränklich war und Fritz Haber sich kaum darum kümmerte, musste Clara die Pflege übernehmen und ihre Arbeit erst einmal in den Hintergrund schieben. Manchmal half sie ihrem Mann bei seiner Arbeit und war öfters an seinen Werken beteiligt (z.B. „Thermodynamik technischer Gasreaktionen“).1)
Als Fritz 1906 Professor wurde und nun ich der Öffentlichkeit auftrat, musste auch Clara sich in der Öffentlichkeit wie eine Frau eines Professors zeigen, was sie aber nicht gerne tat. Sie suchte jede Gelegenheit sich zurückzuziehen. Sie musste mit Schmerz sehen, wie sich Fritz dem Ehrgeiz nach Karriere hingab. Dabei kam es immer wieder zu Auseinandersetzungen zwischen ihnen.1)
Aber auch in der Ehe gab sie ihren Beruf nicht ganz auf. Mit großem Idealismus und innerem Engagement stellte sie sich der Aufgabe, Vorträge über „Naturwissenschaften im Haushalt“ zu halten.1)
Als 1914 der 1.Weltkrieg ausbrach, war sie empört über die Kriegsbegeisterung. Aber auch ihr Mann war einer von diesen. Sie zog sich immer weiter zurück und sie musste es mitansehen, wie Fritz andere Frauen hofierte.2) Claras Gesundheitszustand war sehr schlecht. Aber während des Krieges richtete sie in freistehenden Räumen des Kaiser-Wilhelm-Institutes, in dem ihr Mann arbeitete, einen Kindergarten ein für Kinder, deren Väter an der Front waren und deren Mütter arbeiten mussten.1)
Nachdem Deutschlands Siegesserie gerissen war, suchten Chemiker Gifte, um die feindlichen Schützengräben bekämpfen zu können. Auch Fritz war dabei und er fand heraus, dass Chlor sehr wirksam war. Clara konnte nicht mit ansehen, wie begeistert ihr Mann nach Giften suchte, um damit Menschen zu töten. Ihr Inneres und Äußeres stimmte schon lange nicht mehr überein. Sie konnte Fritz einfach nicht mehr verstehen. Sie bezeichnete die Entwicklung von Giftgasen als „ein Zeichen der Barbarei, jene Disziplin korrumpierend, die dem Leben neue Einsichten vermitteln sollte.“ Sie wollte ihren Mann noch von dem Vorhaben abbringen, aber Fritz sah nur seinen Erfolg und seine Karriere. Als nun Fritz an die Front fuhr, um das Chlorgas zu testen, sprach Clara mit Wissenschaftlern in Berlin. Als nun Fritz mit seinem Chlorgas großen Erfolg hatte, wurde er zum Hauptmann. Er warf Clara vor, sie sei ihm in den Rücken gefallen, weil sie mit Wissenschaftlern geredet hatte.1)
Als Fritz sich dann feiern ließ und schließlich alle Gäste gegangen waren, zog sich Clara in ihr Zimmer zurück und schrieb Abschiedsbriefe. Danach nahm sie die Dienstwaffe ihres Mannes und erschoss sich im Garten. Sie starb nach zwei Stunden. Clara konnte ihre Situation nicht mehr ertragen und vor allem die Taten ihres Mannes nicht mittragen.1)
Quellen:
Biographie Clara Immerwahr - Unterrichtsmaterialien Chemie, Stark Verlag, Berühmte Chemiker
http://www.ph-freiburg.de/Projekt-ILL/Frauen/immerwahr/clara_immerwahr.htm
Porträt: Clara Immerwahr
Von Sebastian Glock
Clara Immerwahr wurde am 21.06.1870 in einem Gutshaus in Polkendorf bei Breslau geboren. Sie ist die jüngste Tochter von vier Kindern. Ihre Eltern sind Dr. Philipp Immerwahr und Anna Immerwahr.
Philipp Immerwahr studierte Chemie und versuchte sich selbstständig zu machen. Dieser Versuch scheiterte jedoch und er zog sich in die Landwirtschaft zurück. Er heiratete Anna die gleichzeitig seine Cousine war. Sie brachten vier gesunde Kinder zur Welt die zunächst ihren schulischen Unterricht von einem Hauslehrer bekamen. Claras ganze Familie ist jüdischen Glaubens aber ihre Bräuche werden nicht mehr gepflegt. Clara Immerwahr ist eine gute, aufmerksame und begeisterte Schülerin die zusammen mit ihren Schwestern eine Töchterschule besucht. Sie ist sehr in naturwissenschaftlichen Fächern interessiert. Nach der Schule heiraten die beiden älteren Schwester, jedoch Clara möchte ihrem Bruder nacheifern und ebenfalls studieren.
Wie der Zufall es so wollte lernt Clara in der Tanzschule Fritz Haber kennen und verliebt sich in ihn. Die beiden wollten früh heiraten aber die Eltern von Fritz Haber ließen dies nicht zu. 1890 stirbt Claras
Mutter an Krebs. In den folgenden Jahren macht Fritz sein Examen und Clara interessiert sich nun immer mehr für Chemie. Frau Immerwahr schaffte 1897, trotz der Vorurteile Frauen gegenüber, ihre Reifeprüfung am Realgymnasium. Clara beginnt nun ihr Studium und ist begeistert von den Chemievorträgen. In Chemie will sie auch ihre Doktorarbeit machen, wozu sie am 28.06.1900 ihre Zulassung zu bekommt. Am 22.12.1900 erhält sie feierlich ihre Doktorwürde.


Fritz Haber macht Clara Immerwahr 1901 erneut einen Heiratsantrag den sie zunächst ablehnt, aber dann doch annimmt. Sie heiraten im August 1901. Im Juni des nächste Jahre kommt der gemeinsame Sohn Hermann zur Welt. Claras gesundheitlicher Zustand verschlechtert sich in den folgenden Jahren stetig. Sie sollte sogar in eine nervenärztliche Klinik kommen. Mittlerweile ist auch Claras Vater gestorben. Fritz Haber ist nur noch in seine Arbeit vertieft und kümmert sich kaum noch um seine Familie. Nach einem Versuch der 90 Stunden dauerte, schaffte Haber die Ammoniaksynthese. Claras körperlicher Zustand wird noch schlimmer und sie bricht erneut zusammen. Claras Konflikt zwischen äußeren Rollenspiel und innerer Wahrheit spitzt sich auch durch die hohe Position, die Fritz nun besitzt, zu. Am 01. August 1914 beginnt der erste Weltkrieg. Fritz Haber wird zum Chef der Zentralstelle für Chemie ernannt. Fritz entwickelt für die Front Giftgase, Clara versucht ihn eindringlich
davon abzubringen. Leider scheitert dieser Versuch kläglich. Am 22. April wird der Giftgasangriff gestartet und Fritz wird daraufhin befördert. Clara will ihn erneut zur Vernunft bringen, aber er kontert damit, dass sie ihm in den Rücken falle. In der gleichen Zeit erwischt sie ihren Mann mit einer anderen
Frau. Sie erträgt ihr Leben unter dieser Last nicht mehr und begeht am 2. Mai 1915 Selbstmord, mit der Dienstwaffe ihres Mannes. Am gleichen Tag wurde Fritz Haber an die Ostfront geschickt.
Seit 1991 gibt es die Clara-lmmerwahr-Auszeichnung. Mit dieser Auszeichnung werden Personen geehrt, die sich in ihrem Beruf, an ihrem Arbeitsplatz ungeachtet persönlicher Nachteile aktiv gegen Krieg, Rüstung und gegen die anderen Bedrohungen für die Grundlagen menschlichen Lebens eingesetzt haben.
An der Dortmunder Universität gibt es seit dem 15.11.2000 das Clara-lmmerwahr-Mentoring-Projekt. Es wurde nach ihr benannt, weil sie sich für ein Chemiestudium entschied, in einer Zeit wo es für Frauen unüblich war.
Quellen :
1. www.ph-freiburg.de/Projekt-ILL/Frauen/immerwahr/Bilder
2. Biographie Clara Immerwahr - Unterrichtsmaterialien Chemie, Stark Verlag, Berühmte Chemiker
Ammoniakdüngung und landwirtschaftliche Ertragssteigerung
von Christopher Hahne
Als Justus von Liebig 1843 die Agrikulturchemie gründete, sollte als neues Prinzip in der Landwirtschaft gelten, dem Boden im vollen Maße zurück zu geben, was ihm durch die Ernte genommen wird1.
Auf einer landwirtschaftlich genutzten Anbaufläche herrscht, ohne die Einwirkung eines Landwirtes ein
Kreislauf, der für Pflanzen und Tiere lebenswichtig ist.
In jedem lebenden Organismus ist Stickstoff enthalten und für diesen auch lebensnotwendig. Da es, bis auf einige wenige Ausnahmen, für Lebewesen nicht möglich ist Stickstoff aus der Luft zu gewinnen, existiert in der Natur ein Verfahren, in dem dieser Stoff durch mehrere Stationen reist und schließlich wieder am Ausgangspunkt ankommt, dem Stickstoffzyklus2. Er beginnt, wenn Pflanzen oder Tiere sterben und verwesen. Sogenannte Zersetzer (Bakterien, Pilze...) geben dann zunächst den Stickstoff als Ammonium (NH4+) an den Boden ab3. Pflanzen sind zwar in der Lage Ammonium aufzunehmen, bevorzugen aber Nitrate (NO3-). Diese werden im Boden von den Bakterien, Nitrosomas und Nitrobacter aus NH4+ über eine Zwischenstufe, das Nitrit (NO2-) oxidiert. Die Nitrat-Ionen sind für Pflanzen lebenswichtig, da sie aus ihnen körpereigene Eiweißstrukturen herstellen4. Nun können pflanzenfressende Tiere den Stickstoff durch die Nahrung aufnehmen. Der Kreislauf schließt sich.
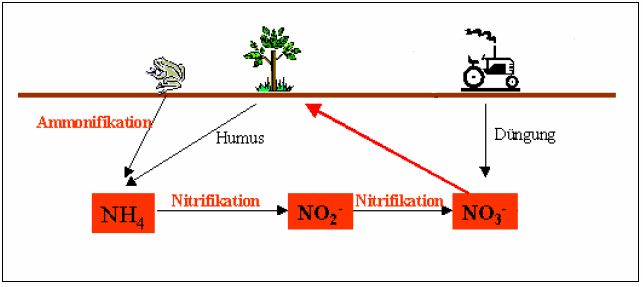
VereinfachteDarstellung des Stichstoffkreislaufes
(Bildquelle: Alfried Krupp Schülerlabor - Der Stickstoffkreislauf im Boden S.3)
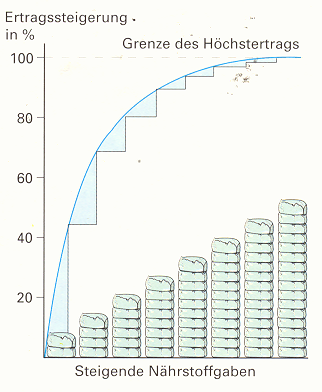
Da wir hier allerdings von einer landwirtschaftlich genutzten Fläche ausgehen, kann dieser Kreislauf nicht funktionieren. Durch das Ernten von Pflanzen gelangt nicht genug Ammonium zurück in den Boden. Auf Dauer würde der Boden unfruchtbar werden und könnte nicht weiter genutzt werden. Deswegen düngt man die Anbaufelder, um diesen Prozess auszusetzen. Dies wurde ermöglicht durch die Erfindung des Kunstdüngers, der eine Weiter-entwicklung aus dem, im Haber-Bosch-Ver-fahren produzierten Ammoniak, darstellt4. Folglich gibt man durch Düngen dem Boden das zurück, was ihm durch die Nutzung verloren geht. Zusätzlich lässt sich, durch genau dosierten Einsatz der Ertrag steigern. In den meisten Fällen allerdings wird mehr gedüngt, als notwendig ist. Linear zunehmende Düngung führt zur Schädigung des Bodens2.
Pflanzen nehmen nur soviel Düngemittel auf, wie sie selbst zum Leben brauchen4. Wird die Dosis trotzdem erhöht, werden die zu erwartenden Ertragssteigerungen immer geringer. Überflüssiges Nitrat verbleibt so im Boden, bis es durch Regen ins Grundwasser gespült wird und zu großen Schäden an Ökosystemen wie z.B. Gewässer oder auch, durch zu hohe Konzentration im Trinkwasser, am Menschen führt2. Es ist möglich, mit Hilfe von Bodenanalysen, die beste Menge an Dünger für ein Feld zu bestimmen, jedoch führt der Anbau von Sonderkulturen immer wieder zu einer überhöhten Menge und dies zu einer Schädigung der Natur.
Insgesamt sollte das Prinzip von Liebig, auch in der heutigen Landwirtschaft mehr Beachtung finden, um auch zukünftig noch gesunde Landwirtschaft betreiben zu können.
Quellen :
1. Tausch-Wachtendonk, Chemie SI, C.C. BuchnerVerlag,1996, S.18Of
2. Landschaftsökologie - Oberstufengeographie - bsv-Verlag, 1997, S.114-117
3. Alfried Krupp Schülerlabor - Der Stickstoffkreislauf im Boden S. 2-5
4. M. Jäckel u.a., Chemie heute SI, Schroedel-Verlag, 1993, S.255ff
Ammoniakdüngung und landwirtschaftliche Ertragssteigerung
von Patrick Martel
Die Ammoniakdüngung spielt in der heutigen landwirtschaftlichen Situation eine notwendige Rolle, Wenn es nicht gelungen wäre die Vorteile dieses biochemischen Stoffes zu entdecken, wäre die Ernährung der Weltbevölkerung stark gefährdet. Das der Einsatz dieses Stoffes äußerst wichtig ist, wäre damit klar, allerdings stellt sich nun die Frage, wie das Ganze funktioniert.
Grundsätzlich brauchen die Pflanzen für die Fotosynthese und damit für ihr Wachstum Stickstoff (N2), allerdings sind nur wenige Pflanzen in der Lage den Stickstoff aus der Umgebung zu nutzen, womit für 99% der Pflanzen eine Alternative gesucht werden muss. Diese Alternative heißt Ammoniak (NH3), Das besondere an Ammoniak ist, dass die Stoffe, aus denen Ammoniak hergestellt werden kann, hinter Schwefel am häufigsten in der Natur vorkommende Stoffe sind und damit kaum verbraucht werden können. Also bietet es sich nur an, diese Quelle zu nutzen und damit die Ernährung der Weltbevölkerung zu sichern. Dieser Stoff wird jedoch ausschließlich in chemischen Werken hergestellt und ist so selten in der Natur zu finden.
In der Natur werden organische Verbindungen von Bakterien und Pilzen abgebaut. Diese setzten den Stickstoff erstmal frei. Allerdings entwickelt sich dieser auch ständig weiter und zwar zu einem negativ geladenen Stoff, der nicht besonders schnell von Pflanzen aufgenommen wird und gerät ins Grundwasser und wird weggespült, womit er dann für die Ertragssteigerung verloren geht.
Ziel der Ammoniakdüngung ist es also, pflanzenverfügbaren Stickstoff in ausreichender Menge und zur richtigen Zeit bereitzustellen, sodass ein hoher Ertrag erzielt wird, ohne unwirtschaftlichen und umweltschädlichen Stickstoffverlust zu erzwingen. Hierbei ist zu beachten, dass zuviel des Düngemittels keineswegs zu einer Ertragssteigerung führt. Stattdessen schädigt zu viel Düngung nur dem Boden und die Lebewesen die im Boden leben. Denn es gibt erhebliche Probleme bei zu viel Dünger, also Ammoniak und Pflanzenschutzmittel. Das Landwirtschaftsamt weist z.B. das kein Dünger bei gefrorenem Boden aufgetragen werden darf, nicht in der Nähe von stehenden Gewässern benutzt werden kann und nur soviel Dünger wie überhaupt nötig ist, sollte auch auf die Felder transportiert werden.
Eine Überdüngung führt anschließend dazu, dass die Lebewesen im Boden durch Fluchtreaktionen an die Oberfläche getrieben werden und dort umkommen. Damit ist eine Regeneration des Bodens anschließend schwerer möglich, und fuhrt dazu, dass erneut gedüngt werden muss, was diesen Kreislauf in rollen bringt und eine Gefahr für das Ökosystem darstellt. Diese Gefahr der Gülleüberdüngung besteht bei Mineraldünger sprich Ammoniak nicht. Allerdings besteht hierbei die Gefahr, dass die Stoffe einen erhöhten Anteil an Nitrat vorweisen, der dazu führen kann, dass die Pflanzen an Vitaminen und anderen Inhaltsstoffen verlieren. Es ist also wichtig, dass man eine gesunde Mischung der beiden Düngemittel findet, um mithilfe der Ammoniakdüngung eine landwirtschaftliche Ertragssteigerung zu erreichen.
Man kann also erkennen das die Erfinder und Entwickler wie Haber, Bosch, und zum Beispiel Ostwald und Clara Immerwahr uns mit diesem Stoff, der sowohl Segen (aus landwirtschaftlicher Sicht), als auch Fluch (siehe Weltkrieg) einen großen Gefallen getan haben und die Menschen lernen müssen mit diesem besser umzugehen.
Ammoniakdüngung und Folgen für die Ökologie
von Andreas Cronrath
Seit je her versucht der Mensch die Landwirtschaft weiterzuentwickeln und die Erträge zu steigern, dies war sehr wichtig, denn die Bevölkerung nahm stetig zu und somit musste mehr produziert werden. Eine Technik um die Erträge zu steigern war die des Düngens. Diese Technik werde ich hier darstellen und die dabei auftretenden Probleme erklären.
Früher hat man mit so genannten „Organischen Düngern“ wie Jauche, Mist und Kompost seine Felder gedüngt. Mikroorganismen im Boden haben die Gülle in Nitrat, welcher ein wertvoller Dünger für die Pflanzen ist, umgewandelt. Allerdings laufen diese „Umwandlungsvorgänge“ nur sehr langsam ab und somit dauerte es seine Zeit bis dieser Dünger gewirkt hat.
Seit etwa 150 Jahren wird die „Mineraldüngung“ angewandt. Hierbei werden dem Boden bestimmte Nährstoffe zu einem bestimmten Zeitpunkt zugeführt. Es gibt vier verschiedene Arten von Mineraldüngern, wobei einer ein Volldünger ist, der aus den anderen drei Arten gemischt wird. Es gibt den „Kalidünger“, der aus den Kaliumsalzen aus Kalibergwerken hergestellt wird, den „Phosphatdünger“, der aus Calciumphosphat aus den Phosphatlagern aus Marokko und den USA gewonnen wird. Des Weiteren gibt es noch den „Stickstoffdünger“, der durch das Ammoniak des HABER-BOSCH-Verfahrens hergestellt wird.
Der Vorteil dieser Mineraldünger ist, dass die Nährstoffe wasserlöslich sind und direkt der Erde ohne einen weitern Umwandlungsprozess angereichert werden können.
Allerdings können durch beide Verfahren (Organisches Düngen und dem Mineraldüngen) große Umweltschäden entstehen, wenn man sie in zu großen Mengen einsetzt. Denn dann tritt die Überdüngung ein. Die Gülle hat einen sehr hohen Ammoniakgehalt, der die Haut der Regenwürmer reizt, diese treten dadurch die Flucht an die Erdoberfläche an und sterben dort durch das UV-Licht. Ohne die Regenwürmer würde gäbe es keine Humusproduzenten und keine Nährsalzbinder mehr. Dadurch sterben dann die meisten Wildpflanzen den Gülletod und die Kulturpflanzen reagieren mit Siechtum. Des Weiteren würde die Eutrophierung einsetzen, das heißt dass die Gewässer mit Pflanzennährstoffen (Überdüngung) angereichert werden. Dieser Prozess findet meist in langsam fließenden oder stehenden Gewässern statt und kann durch menschliche Eingriffe stark beschleunigt werden.
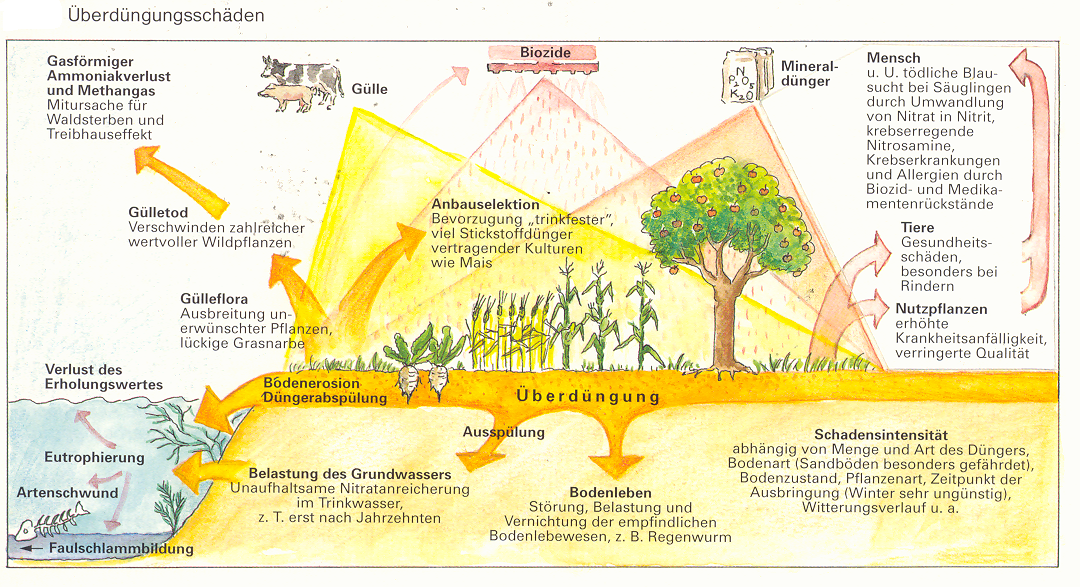
Durch den Menschen zusätzlich eingeführte Nährstoffe sind unter anderem Stickstoffverbindungen (Nitrate und Ammonium-Stickstoff) und Phosphate. Sie stammen aus abgeschwemmten Düngemitteln. Sie gelangen gemeinsam mit natürlichen Nährstoffen in die Gewässer (Gewässerbelastung). In Seen setzt durch das große Nährstoffangebot ein Massenwachstum von Algen ein, sodass die Pflanzen in den unteren Schichten des Sees keine Photosynthese mehr betreiben können. Dadurch folgt dann schließlich der Tot der Pflanze und der Tot des Teiches, er „kippt um“.
Ein weiteres Problem ist die Lebensmittelbelastung. Die Pflanze nimmt das Nitrat, dass dem Boden angereichert wurde auf hat somit einen sehr hohen Nitratwert.
Ein Beispiel: Es gibt Kartoffeln die einen Nitratwert von 500 mg pro Kilo aufweisen. Durch den Verzehr von einem Pfund dieser Kartoffeln durch einen 60 Kg schweren Erwachsenen, wäre der durch die Weltgesundheitsorganisation empfohlener Wert von 219 mg überschritten.
Folgen wären bei Kleinkindern zum Beispiel die tödliche Blausucht. Außerdem kann es zusammen mit den Aminen den krebserregenden Stoff Nitrosaminen bilden.
Quellen:
Wolfsburger Nachrichten vom 23.05.1987
M. Jäckel u.a., Chemie heute SI, Schroedel-Verlag, 1993, S.254-259
Landschaftsökologie – Oberstufengeographie – bsv-Verlag, 1997, S.116-117
www.umweltlexikon-online.de
von Benjamin Sander
Nitrate (Salze der Salpetersäure) kommen in einer bestimmten Konzentration in Böden vor. Sie übernehmen bei der Versorgung der Pflanzen eine sehr entscheidende Rolle, da Pflanzen in der Lage sind, aus den Stickstoffatomen der Nitrate Eiweiße herzustellen. Bei der Verwesung toter Lebewesen, werden durch einen Fäulnisprozess Ammoniak und Ammoniumsalze gebildet, welche wiederum von bestimmten Bakterien (Knöllchenbakterien) zu Nitratsalzen umgewandelt werden können.
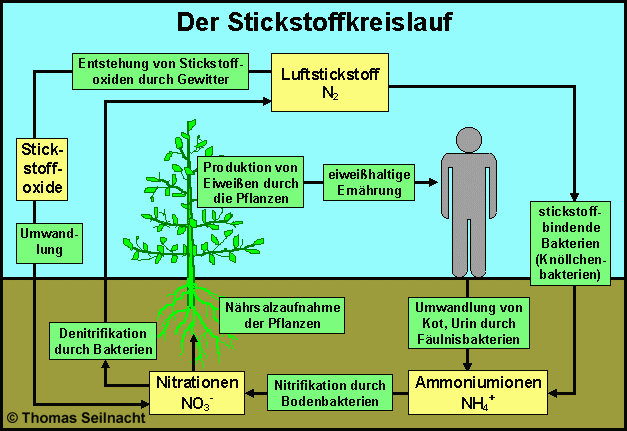
Durch diese Bakterien wird die Nährsalzaufnahme der Pflanze erheblich unterstützt. Andere Bakterien erzeugen durch eine Denitrifikation wieder Stickstoff, welcher an die Atmosphäre abgegeben wird, wodurch der Kreislauf geschlossen ist.
Alle Stickstoffhaltigen Salze, wie Ammoniumnitrat oder Kaliumnitrat eignen sich zur Herstellung von Düngemitteln, was der deutsche Chemiker Justus von Liebig (1803-1873) herausfand. In einem Experiment, in dem er Pflanzen solange verglühte bis nur noch die Asche übrig war, konnte der in den Überresten Salze von folgenden Spurenelementen nachweisen: Stickstoff, Phosphor, Kalium, Natrium, Calcium, Magnesium, Eisen und Kupfer. Damit stellte er fest, dass für das Wachstum der Pflanze vor allem Salze von Bedeutung sind, welche Stickstoff-, Phosphor- und Kaliumatome enthalten, welche die Pflanze für ihren Stoffwechsel benötigt. Bei zu intensivem Düngeinsatz kann jedoch eine Überdüngung eintreten, was zu einer unnormal hohen Anreicherung von Nitraten und Phosphaten im Gemüse und im Grundwasser führen kann. Eine zu hohe Konzentration dieser Stoffe, kann zu erheblichen gesundheitsschädlichen Folgen führen, was eine Studie aus Iowa belegt:
Durch Tests wurden Frauen untersucht, die über eine Zeit von etwa zehn Jahren Trinkwasser mit mehr als 2,5mg Nitrat pro Liter verwendet hatten. Diese Frauen wiesen ein fast drei Mal so hohes Risiko auf, Blasenkrebs zu bekommen wie Frauen, in deren Trinkwasser weniger als 0,4mg Nitrat war.
Die Krebserzeugende Substanz sind in diesem Fall die Nitrosamine, welche durch chemische Prozesse im Körper hergestellt werden:
![]()
Diese Stoffe sind schon in sehr geringen Mengen gefährlich, wodurch die Weltgesundheitsorganisaton (WHO) nicht mehr als 220mg Nitrat pro Tag empfiehlt. Allerdings sind nicht alle Lebensmittel nitrat- oder nitritfrei – in einigen Wurst- und Käsesorten wird Nitrat oder sogar Nitrit als Lebensmittel-Zusatzstoff zur Konservierung zugesetzt.
Ein weiterer Aspekt ist die durch Überdüngung hervorgerufene Gewässerverschmutzung. Obwohl sie in den letzten Jahren deutlich zurückgegangen ist, kann noch nicht von einer endgültigen Entwarnung gesprochen werden. Nach wie vor gelangen immer noch viele Nährsalze aus der Landwirtschaft und aus den Abwässern der haushalte in die Gewässer. Nitrate, Ammoniumsalze und Phosphate werden in geringen Mengen von allen Pflanzen benötigt und sind auch in der Regle immer ausreichend vorhanden. Erst wenn der Mensch zusätzlich Nährstoffe zuführt kann es zu einem Ungleichgewicht im Ökosystem der Gewässer kommen.
Die Verschmutzung eines Gewässers wird durch die Eutrophierung beschrieben.
In einem ganz sauberen Gewässer leben Tiere und Pflanzen in relativ geringer Zahl miteinander.
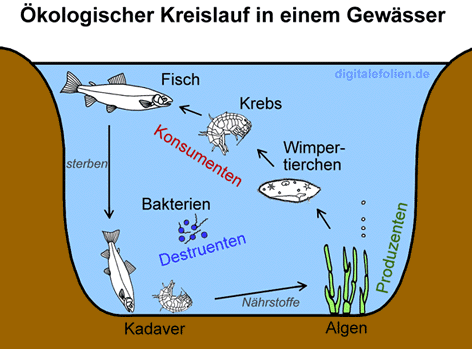
Durch Fremdeinwirkung des Menschen wird dieses Gleichgewicht zerstört. Durch das Hinzuführen der Salze vermehren sich die Algen außergewöhnlich schnell und zahlreich. Dadurch vermehren sich in einer Kettenreaktion auch alle anderen Lebewesen in diesem Kreislauf. Durch die starke Vermehrung der Lebewesen im Wasser vergrößert sich die Zahl an abgestorbenen Lebewesen. Die Bakterien erhalten mehr Nahrung und nehmen zu. Durch die starke Algenvermehrung gelangt kein Licht mehr an den Boden des Gewässers. Die dortigen Pflanzen können keine Photosynthese mehr betreiben, sie sterben und verfaulen. Durch den Sauerstoffmangel sterben alle anderen Lebewesen mit der zeit ab. Ab diesem Zeitpunkt kann sich das Wasser noch erholen, allerdings nur , wenn gewährleistet ist, dass keine weitern Abwässer mehr eingeleitet werden und die Wimpertierchen die Bakterien fressen können (Selbstreinigung des Wassers). Werden jedoch noch mehr Abwässer in das Gewässer eingeleitet, ,,kippt“ das Wasser ,,um“. Durch die hinzukommenden Gifte, die ebenfalls in den Abwässern enthalten sind sterben sogar die restlichen Wimpertierchen ab und das Gewässer ist tot.
Fazit:
Ammoniak spielt eine sehr große Rolle für die Ökologie, von dem Erhalt mancher Pflanzenarten bis hin zu deutlich höherer Produktionsraten an Grundlebensmitteln. Allerdings sind die Folgen des Einsatzes von stickstoffhaltigen Düngemitteln verheerend: Menschen erleiden schwere Krankheiten die ab bestimmten Zeitpunkten irreversibel sind, Abfälle gelangen ungewollt in Gewässer, diese ,,kippen um“. Im Endeffekt gibt es also mehr negative als positive Aspekte in Bezug auf den Einsatz von Düngemitteln in der Landwirtschaft.
Auswirkungen auf Mensch und Umwelt
von Mirjam Thill
Stickstoff, ein Element des Ammoniaks, ist von besonderer Bedeutung für Mensch und Umwelt. So beträgt der Stickstoffgehalt der ganzen Erde 1015 Tonnen. Davon befinden sich 99% für uns nicht sichtbar in der Atmosphäre verteilt. Dort macht es wiederum 78% des Volumens aus. Der Rest verteilt sich in Lithosphäre (Erdkruste und Erdmantel), Hydrosphäre (natürliche Gewässer der Erde) und Biosphäre (Bereiche der Erde, wo Leben möglich ist).
Menschen und Tiere ernähren sich von den Pflanzen und setzen den Stickstoff in den für sie wichtigen Eiweiß um.
Der deutsche Chemiker Justus von Liebig (1803- 1873) fand 1840 in seinem Versuch der Pflanzenverbrennung und anschließende Untersuchung auf Rückstände heraus, dass Stickstoff mit Phosphat, Kalium, Natrium, Calcium, Magnesium, Eisen und Kupfer zu den wichtigsten Nährelementen der Pflanzen gehört. Hier wird der Stickstoff vor allem für den Stoffwechsel zum Aufbau von Eiweiß, Enzymen und Chlorophyll benötigt1.). Pflanzen können den molekular vorkommenden Stickstoff aus der Luft nicht verwerten. Um die Aufnahme von Stickstoff zu ermöglichen wandeln Mikroorganismen diesen in Ammoniak um. Die Umwandlung ist aufgrund der stabilen Dreifachbindung des molekularen Stickstoffs ein sehr energieaufwändiger Prozess, den die Mikroorganismen mit einem speziellen Katalysator, dem Enzym Nitrogenase, verringern. Nun können die Pflanzen den Ammoniak aufnehmen, der dann in den eigenen Aminosäuren eingebaut und an Pflanzenzellen abgegeben wird.
Pflanzen bevorzugen jedoch die Aufnahme von wasserlöslichen Nitraten.
Diese Nitrate werden zuvor von den Bodenbakterien Nitrosomonas und
Nitrobacter aus Ammoniumionen in zwei Stufen gebildet. Zunächst bildet
Nitrosomonas durch Oxidieren von Ammoniumionen über diverse Zwischenprodukte Nitrit, welches vom Nitrobacter, ebenfalls durch oxi- dieren, in Nitrat umgesetzt wird. Dieser Prozess wird in der Chemie Nitrifikation genannt.
In der Ammonifizierung nehmen Pflanzen die Nitrate auf und setzen
diese in organische Verbindungen um, beispielsweise Proteine. Nitrosomonas
 Tiere
und Menschen ernähren sich von den Pflanzen und nehmen die
Tiere
und Menschen ernähren sich von den Pflanzen und nehmen die
Proteine auf. Um den Stickstoffkreislauf zu schließen, wird ein Teil des
Stickstoffs durch Urin und Kot wieder ausgeschieden, um dann von
Fäulnisbakterien in Ammoniumionen verarbeitet zu werden, woraufhin
die Nitrifikation sich wiederholt.
Denitrifikation ist ein der Nitrifikation entgegengesetzter Prozess, der zum
Teil gravierende Folgen für die Umwelt hat. Es wird hierbei also nicht Stick-
stoff verarbeitet und umgesetzt, sondern unter anaeroben Bedingungen Nitrobacter
Nitrat unter mehreren zwischen Schritten molekularer Stickstoff umgesetzt.
Von den Produkten der Zwischenschritte wird einiges an die Umwelt abgeben, was Konsequenzen mit sich zieht. So entstehen Nitrit und Stickstoffoxid. Diese Verbindungen kommen auch durch Gewitter und Abgase der Autos und Fabriken und Verbrennungen zustande. Reagieren diese Verbindungen mit Wasser und Sauerstoff, bildet sich zunächst die Salpetersäure, die später als Saurer Regen wieder in den Erdboden versickert. Saurer Regen verursacht das Sterben der Bäume und anderen Pflanzen2.). Außerdem wird durch diese Verbindungen die Ozonbildung gewährleistet. Die Sauerstoffatome können sich durch UV-Strahlen von den Stickstoffen abspalten und anschließend durch weitere Unterstützung der UV-Strahlen, mit dem in der Luft vorhandenen Sauerstoff, Ozon bilden. Ozon ist im Gegensatz zu Sauerstoff keine molekulare Verbindung des Oxids, sondern eine dreifache. Ein Überschuss an Ozon in Bodennähe ist Atemgift für die Menschen und verursacht Kopfschmerzen, Schleim-hautentzündungen, Atembeschwerden und Hustenreiz. Zudem ist es Krebserregend und am Waldsterben und am Treibhauseffekt beteiligt.
Die Menschen vermehren den Ozongehalt in Bodennähe durch das rücksichtslose Verhalten zur Umwelt und zerstören gleichzeitig die Ozonschicht der Stratosphäre. Fluorchlorkohlenwasserstoffe (FCKW) sind Hauptverursacher des Ozonschichtabbaus. Diese Treibgase steigen bis zur Ozonschicht auf und spalten unter UV-B Einstrahlung Chloratome ab, die sich dann ein Sauerstoffatom des Ozons entreißen und Chloroxid bilden. Das Chloroxid zerfällt anschließend wieder in Chloratom und Sauerstoff und kann somit erneut ein Ozonmolekül angreifen und zerstören. Durch die Ozonzerstörung in der Stratosphäre entsteht nach und nach ein riesiges Ozonloch, was mehr UV-B –Strahlung auf die Erde gelangen lässt und erhebliche Schäden für alle Lebewesen bedeutet. Die Sonnenbrandgefahr und Krebsrate steigen, die Augen werden geschädigt, das Immunsystem wird geschwächt und die Erbsubstanz geschädigt, sodass es denkbar ist, dass Menschen unfruchtbar werden. Die Bodenbakterien werden getötet der Boden wird unfruchtbar gemacht. Infolgedessen werden die Hungersnotkatastrophen steigen3.).
Ein weiteres letztes Zwischenprodukt der Denitrifikation ist das Distickstoffmonoxid (Lachgas). Dieses kann auch bei unvollständigen Reaktionen bei der Ammonifikation und Nitrifikation in die Atmosphäre freigesetzt werden. Mitverantwortlich sind zudem auch Abgase und Verbrennungen. Lachgas ist sowohl bei dem Ozonabbau beteiligt als auch dem Treibhauseffekt. Der Treibhauseffekt bringt nicht nur Klimaveränderungen mit sich, sondern auch Naturkatastrophen, wie Orkane, Sturmfluten und Dürrekatastrophen. Der Meeresspiegel steigt und Wüsten breiten sich aus, was die Folge hat, dass die Menschheit ihrer Lebensgrundlage beraubt wird4).
Allerdings wird nicht nur durch die Denitrifikation molekulares Stickstoff und Distickstoffmonoxid freigesetzt, sondern auch durch unvollständige Reaktionen der Nitrifikation und natürliche Ausstöße der Vulkane2). Man erkennt also, dass ein riesiger Kreislauf entsteht, der andererseits wichtig für den Lebenserhalt auf unserem Planeten sorgt, aber auch erhebliche Folgen hat.

Wie bereits erwähnt ist Stickstoff für das Wachstum und den Erhalt der Pflanzen notwendig. Ist nicht genug Stickstoff im Boden vorzufinden, stellt dies eine Bedrohung für unseren Lebensmittelertrag dar. Um die Lebensmittelversorgung der Weltweiten Bevölkerung sicher zu stellen wird der Boden mit Nährstoffen von Außen versorgt- ,der Boden wird gedüngt.
Bei der Verwesung von Lebewesen und Pflanzen entstehen in einem Fäulnisprozess Stickstoffhaltiges Ammoniak und Ammoniumsalze. Bestimmte Bodenbakterien verwandeln diese wieder zu Nitratsalzen um, um die Aufnahme dieser Elemente für die Pflanzen zu ermöglichen. Dies ist eine natürliche Art von Düngung, bei der Salpeter entsteht, wie Forscher herausfanden. Immer wiederkehrende Hungersnöte veranlassten Forscher, nach einem Mittel zu suchen um die Düngung voran zuschreiten und zu beeinflussen. Zunächst wurden sogenannte Salpetergärten angelegt, um die Bildung von Salpeter zu vereinfachen. Salpeter ist eine Stickstoffhaltige Verbindung, aus der man Nitrate (Stickstoffsalze) gewinnen kann, die man als Düngemittel einsetzte. Diese Salpetergärten waren langgestreckte, regengeschützte Erdhaufen, die aus tierischen Dung, Urin, und Kalk bestanden. Nach 2 Jahren hatte sich dann soviel Salpeter gebildet, dass man aus 6kg Erde, 1 kg Salpeter gewinnen konnte. Die Erde wurde mit Wasserzugabe gekocht, sodass sich das Nitrat darin lösen konnte und bei anschließendem Eindampfen festes Nitrat entstand, meist Calciumnitrat, den man auch Mauersalpeter nennt. Diesen fand man auch an Wänden der Viehställe und Schlachthäuser vor. Hatte man den Salpeter von den Wänden heraus gelöst und gereinigt konnte man ihn ohne weiteres ebenfalls als Düngemittel verwenden.
Da die Bevölkerung in Europa immer weiter zunahm, reichte die Salpeter- Gewinnung allein nicht aus um die Versorgung der Menschen zu erhalten. Ersatz musste geschaffen werden.
Der sudetendeutsche Thaddäus Xaverius Peregrinus Haenke (1761 – 1816) entdeckte als erstes die vielseitige chemische Verwendung des Chilesalpeters, unter anderem gab er auch erste Hinweise der Verwendung des Chilesalpeters zur Herstellung von Düngemittel5).
Als 1820 der Naturforscher Mariano de Rivero in der Wüste Atacama des Norddistriktes von Chile riesige Lager (1-2 Meter dick und bis zu 6000 km lang) des sogenannten Chilesalpeters (Natriumnitrat NaNO3) entdeckte, griff man die Hinweise Haenkes wieder auf und verwendete den Chilesalpeter als Dünger. So erschien nach 1830 der Chilesalpeter auf dem europäischen Markt. Die einheimische Salpeter -Gewinnung verlor nach und nach an Bedeutung, der Import des Chilesalpeters stieg. Somit stieg auch die Bedeutung des Salpeters für Chile.
Bis zur Entdeckung des Nitratvorkommens war die Atcama-Region eine Bedeutungslose Wüstengegend, die an Chile, Peru und Bolivien grenzte. Mit dem Beginn der Nitratförderung gewann die Region an strategischer und wirtschaftlicher Bedeutung für. Der Abbau schaffte Arbeitsplätze und verhalf Chile zu einem wirtschaftlichen Aufschwung. 1873 jedoch bildeten Peru und Bolivien eine „geheime Allianz“ und eigneten sich die chilenischen Firmen an. Dies führte dazu, dass Chile den beiden Nachbarländern im Jahre 1878 den Krieg erklärte und die bolivianische Hafenstadt Antofagasta besetzte. Die militärische Überlegenheit auf See und Land zwang Bolivien 1880 aufzugeben. Peru musste zwei Jahre später seine Machtlosigkeit anerkennen und ebenfalls kapitulieren. Der Salpeterkrieg kostete 14.000 Menschen das Leben, aber sicherte Chile die Salpeterquellen und somit auch den wirtschaftlichen Aufschwung durch dessen Export6).
Die Reserven des Salzes waren allerdings nicht unerschöpflich. Die Förderung gingen mit jedem Jahr weiter zurück. Die Nachfrage stieg stetig, da die Bevölkerung auf Grund der gesamten Verbilligung der Lebenshaltung durch die Produktivitätssteigerung der Landwirtschaft zunehmendes wuchs7). Diese wollte weiterhin ernährt werden. Somit waren noch höhere Ernteerträge gefragt, die nur unter Beteiligung von Stickstoff gewährleistet werden konnte. Wieder suchte man nach einer Möglichkeit einen Ersatz für Salpeter zu gewinnen.
Als Fritz Haber 1905 begann eine Möglichkeit der chemischen Stickstofffixierung zu finden, um dies in
der Landwirtschaft einzusetzen, war das Vorkommen des molekularen Stickstoffs in der Luft bereits bekannt. Haber ließ sich auf die große Herausforderung diesen Stickstoff zu binden ein und entwickelte nach einigen Jahren intensiver Forschung ein Verfahren um diesen in einer Apparatur mit Hilfe von Wasserstoff Ammoniak zu erzeugen. Seine Entdeckung wurde der Badischen Anilin- und Sodafabrik (BASF) vorgestellt, die Carl Bosch damit beauftragte eine industrielle Umsetzung dieses Verfahrens zu entwickeln. 1913 wurde dann zum erstenmal Ammoniak Industriell hergestellt8). Durch die Entwicklung des Haber-Boschverfahrens verlor der Import des Chilesalpeters schlagartig an Konkurrenzfähigkeit, die Minen wurden größtenteils unwirtschaftlich und wurden brach gelegt6).
Die Tagesleitung der neuen Ammoniakanlage betrug zu der Zeit 30 Tonnen Ammoniak. Heute werden Weltweit 100 Millionen Tonnen Stickstoff zu Ammoniakumgesetzt. Aus 4/5 des hergestellten Ammoniaks werden mit dem Ostwald-Verfahren unter Zugabe von geeigneten Katalysatoren, Salpetersäure hergestellt. Dessen Nitrate (Salze) als Düngemittel eingesetzt werden.
Düngung jeglicher Art bedeutet dem Boden die Nährstoffe wieder zuzuführen, die durch die Ernte entzogen wurden und im Hinblick auf die nächste Ernte zu ergänzen. Überdüngung ist daher widersinnig, verursacht nur Kosten und Umweltschäden. Sei es organischer Dünger, Gründünger oder mineralischer Dünger, alle führen zu einer Gefahr der Überdüngung des Bodens, werden diese zu intensiv angewandt. Die wichtigsten Dünger sind Verbindungen die Stickstoff enthalten, wie Ammonium und Nitrate. Nitrate und Phosphate reichern sich in Grundwasser, Obst und in Gemüse an, was zu einer gesundheitlichen Gefährdung führen kann. Zu viel Nitrat setzt die Lagerhaltbarkeit der Ernteerträge ab und die Tragfähigkeit an Vitamin-C. Im Darm wird das Nitrat zu Nitrit umgewandelt. Dieses Nitrit behindert den Sauerstofftransport im Blut und kann zu einer tödlichen Blausucht bei Babys führen. Reagieren Nitrite mit Produkten der Eiweißverdauung können sich krebserregende Nitrosamine bilden. Was der Boden an Dünger nicht aufnehmen kann wird durch den Regen und Grundwasser in die Gewässer gespült. Bevor der Überschuss in die Gewässer gelangt herrscht ein Gleichgewicht zischen Algen, Fischen und Bodenbakterien. Algen können Kohlenstoffdioxid aufnehmen und in Sauerstoff umwandeln, den die Fische und Bakterien brachen. Die Fische und Bakterien ernähren sich von den Algen. Abgestorbene Algen werden von den Bakterien in Kohlendioxid und Mineralsalzen umgesetzt um den Lebenserhalt der Algen zu sichern.

Durch die Überreste der Nitrate und Phosphate, die in die Gewässer gelangen ist ein Übergehalt an Nährstoffen vorhanden, die Algen vermehren sich explosionsartig (Eutrophierung) 9). Die Lebewesen die sich von den Algen ernähren, vermehren sich ebenfalls. Durch die Eutrophierung gelangt allerdings weniger Licht auf den Gewässergrund und die Photosynthese kann nicht mehr vollzogen werden, der Sauerstoffgehalt nimmt ab, die Lebewesen des Wassers sterben. Die Bakterien setzten die Algen weiterhin um, brauchen allerdings mehr Sauerstoff. Der erhöhte Bedarf an Sauerstoff für die Bakterien hat die Konsequenz, dass der Sauerstoffmangel weiter zunimmt und weitere Lebwesen sterben. Bekommen die Bakterien nicht genügend Sauerstoff, setzten sich die Bakterien durch die ohne Sauerstoff reagieren können und setzen die Algen in die Faulgase Ammoniak und Schwefelwasserstoff um. Das Gewässer kippt um und kann sich nicht mehr selbst reinigen10).
Stickstoff war nicht nur für die Herstellung von Düngemitteln relevant, sondern wurde auch in der Produktion von Schießpulver und Sprengstoff gebraucht. Als die Alliierten während des ersten Weltkrieges dem deutschen Kaiserreich, durch die Blockade Grossbritanniens, die Versorgung mit Chilesalpeter verwehrten, war es offensichtlich, wie der Krieg ohne den Zugang zu dem Rohstoff ausgehen würde. So wurde das Haber-Bosch-Verfahren, nicht nur für die Agrarwirtschaft von Bedeutung sondern auch für die Kriegswirtschaft. Im November 1914 Munition war die Munition aufgebraucht. Deutschland brauchte eine neue Kriegswaffe. So entwickelten Chemiker die Idee Gase als Vernichtungsmittel ein zusetzen. Zunächst gab es das Giftgas, dies war jedoch kostspielig und wies andere Probleme auf. So wurde Chlorgas verwendet. Der Erste Weltkrieg forderte über 9 Millionen Menschenleben11).
Stickstoff ist also von großer Bedeutung für Mensch und Umwelt. Ein Mangel an Stickstoffgehalt in jeglichen Bereichen, nicht nur im Boden sondern auch der Mangel an Stickstoff für die Waffenindustrie, hat Folgen die einerseits positiv zu bewerten, andererseits auch negativ zu bewerten sind. Dünger lässt die Pflanzen wachsen, Überdüngung bringt Umweltschäden auf und die Verwendung von Stickstoff in der Waffenproduktion kostet später vielen unschuldigen Menschen das Leben. Geht der Rohstoff aus sucht man anderweitige Mittel als Waffen einzusetzen, die viel weiter reichen als Schießpulver und Sprengstoff.
Quellen :
www.seilnacht.com/Chemie/ch_kno3.htm (Düngemittel)
www.geographie.ruhr-uni-bochum.de/institut/documents/Microsoft%20Word%20-%20Skript-Stickstoff.pdf
www.umweltlexikon-online.de/fp/archiv/RUBluft/Treibhauseffekt.php
www.jack-steinberger-gymnasium.de/aktiv/natmat/projekte/ammoniak
www.bpb.de/publikationen/YSVJZZ,0,0,Deutschland_wird_industrielle_Weltmacht.html
Tausch/v.Wachtendonk, Chemie S II, Stoff- Formel- Umwelt S.109- S.110
Tausch/v.Wachtendonk, Chemie S II, Stoff- Formel- Umwelt S.259
Ammoniak – Auswirkungen auf Mensch und Umwelt
von Dominik Rüsche
Ammoniak ist ein sehr nützliches chemisches Produkt für viele Zweige der Industrie und der Landwirtschaft, jedoch kann Ammoniak auch negative Auswirkungen , nicht nur auf den Mensch selbst, sonder auch auf seine direkte Umwelt, haben.
Folgen für Umwelt und Mensch:
Der Boden ist sozusagen die Lebensgrundlage für alle auf der Erde zu findenden Lebewesen. Natürlich wird auch der Boden stark vom Handeln des Menschen beeinflusst, allerdings schränkt auch der Boden das Handeln der Menschen teilweise ein.
Wegen seiner großen Bedeutung hinsichtlich des Lebens sollte besonders großer Wert auf den Schutz des Bodens gelegt werden, was allerdings nicht immer der Fall ist.
Durch den Einsatz von Gülle und anderen Düngern wird zu heutiger Zeit der Boden einer sehr starken Belastung ausgesetzt, da die Düngerarten in viel zu großen Mengen und in falscher Form aufgebracht werden.
Da Dünger einen hohen Ammoniakanteil besitzen, werden z.B. Regenwürmer, die für die wichtige Humusbildung des Bodens stark mitverantwortlich sind, vertrieben oder abgetötet.
Weiterhin fließt ein beachtlicher Teil des Düngers ins Grundwasser und „verseucht“ es regelrecht, was wiederum schwerwiegende Folgen für andere Lebewesen haben kann. Bei diesen Lebewesen muss es sich nicht ausschließlich um Tiere handeln. Auch der Mensch kann von dieser Art der Vergiftung betroffen sein. So kann z.B. die unter Umständen tödliche Blausucht bei Säuglingen auftreten.
Wie man sieht, hat ein falscher Einsatz von Düngemitteln einen weitreichenden Einfluss auf alle Tiere, Pflanzen und auch Menschen, da alle Systeme, wie z.B. der Wasserkreislauf, eng zusammenhängen und teilweise gar nicht klar zu trennen sind.
Um die Ausfuhr von Dünger einzuschränken, müssten neue Gesetze entworfen und verabschiedet werden. Um die deutschen Landwirte allerdings gegenüber den anderen europäischen Landwirten konkurrenzfähig zu halten, müssten die Beschlüsse und Gesetze auf EU – Ebene getroffen werden, was die Einbringung und Verwirklichung dieser nicht gerade vereinfacht.
Wie groß der Einfluss allein von falschem Einsatz von Düngemitteln sein kann zeigt die folgende Abbildung:

Jedoch stellt Ammoniak nicht nur in Form von Dünger eine Belastung der Umwelt und der Menschen dar. Auch bei vielen industriellen Prozessen wird Stickstoff freigesetzt.
Zwar ist Stickstoff gleichzeitig auch ein unerlässlicher „Rohstoff“ für Pflanzen, jedoch sind die meisten Lebewesen, besonders Pflanzen, nur in der Lage Stickstoff in atomarer Form (N) aufzunehmen. Der größte Teil ( etwa 99% ) des Stickstoffes kommt allerdings molekular vor, sprich N2 .
Nur wenige Lebewesen sind in der Lage diesen fest verknüpften Stickstoff aufzunehmen.
Welche Folgen Stickstoff noch haben kann zeigt die folgende Tabelle sehr deutlich:

Quellen : 1. Tausch / v. Wachtendonk–Auflage 1993–C.C. Buchner-Verlag–Chemie SII – 1993, S.109
2. Landschaftsökologie – Oberstufengeographie – bsv-Verlag, 1997, S.114-115
3. Artikel: „Fleischgenuss und Güllefluss“ aus der SSV vom August 1991
von Lena Herting
Schon im vorigen Jahrhundert waren Stickstoff-Verbindungen als Dünger bekannt. So düngte man in Europa den Boden mit dem aus Chile importierten „Chilesalpeter“ (Natriumnitrat, NaNO3). Die Reserven dieses Salzes waren aber nicht unerschöpflich und mussten bald zur Neige gehen. Also musste man Ersatz geschaffen.
Die Herausforderung an die Chemiker war umso größer, da man schon mehrere Jahrzehnte vergeblich nach einem kostengünstigen Verfahren gesucht hatte, Stickstoff chemisch zu binden.
Eine der größten Errungenschaften der Chemie war vollbracht, als es am 2. Juli 1909 dem jungen Karlsruher Professor Fritz Haber nach sechsjähriger zäher Arbeit gelang, bei hohem Druck mit Hilfe eines Osmium-Katalysators Wasserstoff und Luftstickstoff zu Ammoniak zu synthetisieren.
Als er das erste flüssige Ammoniak erhielt, begab er sich voller Begeisterung zu seinem Lehrer und sagte: “Herr Geheimrat, es tropft!“.1) Er stellte seine Entdeckung den Leitern der Badischen Anilin- und Sodafabrik (BASF) vor. Die BASF beauftragten den 35-jährigen Carl Bosch, das von Haber entdeckte Verfahren im Industriemaßstab umzusetzen. Mit bewundernswerter Genialität löste Bosch die Probleme, die beim Arbeiten mit Wasserstoff unter hohem Druck auftraten, innerhalb eines Jahres. Die Reaktionsbehälter mussten einem hohen Druck von 200 Atmosphären standhalten, so fand man eine Lösung in einem doppelwandigen Gefäß, da bei Vorversuchen zahlreiche einwandige Behälter durch bei der Reaktion diffundierenden Wasserstoff angegriffen und anschließend geplatzt waren. Auch der von Haber verwendete Katalysator Osmium war für eine großtechnische Anwendung nicht geeignet da nicht in größeren Mengen vorkommend.
Paul Alwin Mittasch und seine Mitarbeiter suchten in der gleichen Zeit in über 20.000 Versuchen unter ca. 3000 Stoffen nach einem geeigneten Katalysator. Dieser musste vor allem billiger sein als der von Haber benutzte Osmiumkatalysator. Auch ihre Arbeit war erfolgreich und so konnte im Jahr 1913 die erste Industrieanlage der Welt bei BASF die Ammoniakproduktion aufnehmen. Ihre Tagesleistung betrug 30 Tonnen Ammoniak. Leider wurden während des bald darauf ausgebrochenen 1. Weltkrieges große Mengen Ammoniak auch zur Herstellung von Schießpulver verwendet. Unter der Leitung von Haber wurden sogar Reiz- und Kampfstoffe entwickelt, die auch zum Einsatz kamen.
Die chemische Industrie profitierte von dem Düngemittel-Boom als Schwefelsäure-Lieferant , welche zum Aufschließen bestimmter Mineralsalze diente.

Der stark zunehmende Verbrauch, die Begrenztheit der Salpetervorkommen, sowie Autarkieüberlegungen führten dazu, dass man seit den neunziger Jahren nach einem Verfahren suchte, aus Luftstickstoff Dünger herzustellen. In der Zeit vor dem Ersten Weltkrieg gelang es, drei Verfahren bis zur kommerziellen Anwendung zu bringen, eines davon war das Haber-Bosch-Verfahren. Das kurz vor Kriegsausbruch weitgehend überführte Verfahren erlebte in Deutschland seinen Ausbau während des Krieges, jetzt aber nicht mehr für die Herstellung von Düngemitteln, sondern zur Sprengstoffproduktion. International setzte es sich dann in der Nachkriegszeit durch und blieb bis heute das wichtigste Verfahren für die Herstellung von Stickstoffdünger.
Quellen :
Chemie SII, Stoff - Formel - Umwelt von Tausch / v. Wachtendonk, S.109
Propyläen, Technik Geschichte seit 1914, Ullstein Verlag,1997, S.30ff.
Der geschichtliche Aspekt der Ammoniaksynthese
von Rebecca Spence
 Der
Ausbruch und Verlauf des ersten Weltkrieges veranlaßten die am
Krieg beteiligten Staaten zu einer Intensivierung der
Rüstungsforschung. Besonders für Deutschland machte dies
verstärkte Anstrengung bei der Entwicklung und Produktion von
Ersatzstoffen nötig. So entwickelten aufgrund der starken
Nachfrage die Chemiker Fritz Haber und Carl Bosch die
Ammoniaksynthese, (nach ihren Erfindern das Haber-Bosch-Verfahren
genannt) das zur Salpetererzeugung diente. Salpeter war für die
Produktion von Sprengstoff ebenso unerläßlich, wie in der
Landwirtschaft zur Düngung.
Der
Ausbruch und Verlauf des ersten Weltkrieges veranlaßten die am
Krieg beteiligten Staaten zu einer Intensivierung der
Rüstungsforschung. Besonders für Deutschland machte dies
verstärkte Anstrengung bei der Entwicklung und Produktion von
Ersatzstoffen nötig. So entwickelten aufgrund der starken
Nachfrage die Chemiker Fritz Haber und Carl Bosch die
Ammoniaksynthese, (nach ihren Erfindern das Haber-Bosch-Verfahren
genannt) das zur Salpetererzeugung diente. Salpeter war für die
Produktion von Sprengstoff ebenso unerläßlich, wie in der
Landwirtschaft zur Düngung.
 Dem Karlsruher
Chemieprofessor Fritz Haber war es 1909 gelungen (schon damals
unterstützt durch die BASF) bei hohem Druck mit Hilfe eines
Osmium-Katalysators Wasserstoff und Luftstickstoff zu Ammoniak zu
synthetisieren. Carl Bosch entwickelte bei der BASF die bis 1913
diese Laborlösung zur industriellen Anwendungsreife weiter.
Dabei waren zahlreiche verfahrenstechnische und chemische Probleme zu
bewältigen. Die Reaktionsbehälter mußten einem hohen
Druck von 200 Atmosphären standhalten, so fand man eine Lösung
in einem doppelwandigen Gefäß, da bei Vorversuchen
zahlreiche einwandige Behälter durch bei der Reaktion
diffundierenden Wasserstoff angegriffen und anschließend
geplatzt waren. Auch der von Haber verwendete Katalysator Osmium war
für eine großtechnische Anwendung nicht geeignet da nicht
in größeren Mengen vorkommend. In Zehntausenden von
Versuchen fand man bei der BASF schließlich einen geeigneten
Katalysator.
Dem Karlsruher
Chemieprofessor Fritz Haber war es 1909 gelungen (schon damals
unterstützt durch die BASF) bei hohem Druck mit Hilfe eines
Osmium-Katalysators Wasserstoff und Luftstickstoff zu Ammoniak zu
synthetisieren. Carl Bosch entwickelte bei der BASF die bis 1913
diese Laborlösung zur industriellen Anwendungsreife weiter.
Dabei waren zahlreiche verfahrenstechnische und chemische Probleme zu
bewältigen. Die Reaktionsbehälter mußten einem hohen
Druck von 200 Atmosphären standhalten, so fand man eine Lösung
in einem doppelwandigen Gefäß, da bei Vorversuchen
zahlreiche einwandige Behälter durch bei der Reaktion
diffundierenden Wasserstoff angegriffen und anschließend
geplatzt waren. Auch der von Haber verwendete Katalysator Osmium war
für eine großtechnische Anwendung nicht geeignet da nicht
in größeren Mengen vorkommend. In Zehntausenden von
Versuchen fand man bei der BASF schließlich einen geeigneten
Katalysator.
So profitierte vor allem die BASF von dem Haber-Bosch-Verfahren. Die Abkürzung BASF steht für Badische Anilin- & Soda-Fabrik AG1, die 1865 in Mannheim von Friedrich Engelhorn zur Produktion von Farbstoffen gegründet wurde. Nach der Entwicklung des Haber-Bosch-Verfahrens 1908/12, welches der Erzeugung von künstlichen Düngemitteln diente, erweiterte die BASF ihre Produktpalette auch um Düngemittel. Aufgrund dieses Monopols konnte ein neues Werk in Leuna errichtet werden, was zur ausreichenden Sprengstoffversorgung im 1. Weltkrieg notwendig wurde.
Schon seit Beginn des 19.Jahrhuunderts hatte sich in den meisten Ländern eine Düngemittel-industrie zu entwickeln begonnen, die natürlich vorkommende Mineralsalze oder Abfallprodukte aus industriellen Prozessen zu Düngemitteln verarbeitete. Die chemische Industrie profitierte von dem Düngemittel-Boom als Schwefelsäure–Lieferant , welche zum Aufschließen bestimmter Mineralsalze diente.
Der stark zunehmende Verbrauch, die Begrenztheit der Salpetervorkommen, sowie Autarkieüberlegungen führten dazu, daß man seit den neunziger Jahren nach einem Verfahren suchte, aus Luftstickstoff Dünger herzustellen. In der Zeit vor dem Ersten Weltkrieg gelang es, drei Verfahren bis zur kommerziellen Anwendung zu bringen, eines davon war das Haber-Bosch-Verfahren. Das kurz vor Kriegsausbruch weitgehend überführte Verfahren erlebte in Deutschland seinen Ausbau während des Krieges, jetzt aber nicht mehr für die Herstellung von Düngemitteln, sondern zur Sprengstoffproduktion. International setzte es sich dann in der Nachkriegszeit durch und blieb bis heute das wichtigste Verfahren für die Herstellung von Stickstoffdünger.
Für die gesamte Entwicklung wurden mehrere Nobelpreise vergeben, z. B. 1918 der Nobelpreis für Chemie an Fritz Haber sowie 1931 für Carl Bosch (zusammen mit Friedrich Bergius), und zwar erstmalig für eine technische Umsetzungsmethode.2
Quellen :
www.geschi.de/glossar/wiki,index,goto,Haber-BoschVerfahren.html
Propyläen Technik Geschichte seit 1914, Ullstein Verlag,1997, S.180, 384-7
von Maja Ribinski und Artur Maz
Gleichgewichtsreaktion der Ammoniaksynthese:
N2
+ 3 H2 ![]() 2 NH3 ; HR
= -93 kJ
2 NH3 ; HR
= -93 kJ
Die Ammoniaksynthese verläuft ziemlich stark exotherm und mit einer Volumenverringerung. Sie besitzt eine hohe Aktivierungsenergie.
Daraus ergeben sich für eine kostengünstige Ammoniaksynthese folgende Reaktionsbedingungen:
Nach dem Prinzip vom kleinsten Zwang (Prinzip von Henry Louis de Chatelier) verschiebt sich das Gleichgewicht bei hohem Druck nach rechts und aus diesem Grund sollte bei hohem Druck gear- beitet werden.
2. Da die Ammoniaksynthese exotherm verläuft, liegt das Gleichgewicht bei niedrigerer Temperatur
mehr nach rechts. Eine niedrige Arbeitstemperatur kommt nicht in Frage, da allein bei 200 °C die
Ammoniaksynthese aufgrund der hohen Aktivierungsenergie sehr langsam verläuft. Daher muss
eine Arbeitstemperatur bestehen, bei der sich das Gleichgewicht schnell einstellt und der Ammoni-
akanteil im Gasgemisch trotzdem hoch genug ist.
3. Die erforderliche Senkung der hohen Aktivierungsenergie der Ammoniaksynthese kann mit Hilfe
von Katalysatoren herabgesetzt werden. Diese Katalysatoren müssen eine hohe Wirksamkeit und
Resistenz besitzen und zugleich kostengünstig sein.
Diese Forderungen haben beim Haber-Bosch-Verfahren zu folgenden technischen Lösungen geführt:
Die Ammoniaksynthese wird bei Drücken von 200 bar bis 300 bar und Temperaturen von 450°C bis 500°C in Gegenwart eines Katalysatorsystems durchgeführt, das hauptsächlich aus
Eisen(II)- Eisen(III)- oxid Fe3O4 besteht. Wenn das Eduktgemisch aus Wasserstoff und Stickstoff unter diesen Bedingungen das Katalysatorbett durchströmt, enthält das Gasgemisch beim Austritt aus dem Reaktor einen Volumenanteil von 15% bis 25% Ammoniak. Der Rest besteht aus nicht umgesetzten Edukten. Dieser Nachteil des Ammoniak- Hochdruckreaktors wird aber bei der Gesamtkonzeption der großtechnischen Anlage als kontinuierliches Verfahren aufgehoben.
Entscheidend für die Reaktion ist die Zusammensetzung und Oberflächenstruktur des Katalysators. Durch einen hohen Zerteilungsgrad erhält der Katalysator eine sehr große Oberfläche, auf der sich durch die Reaktion des Wasserstoffs mit dem Eisenoxid kleine „Eisen- Inseln“ bilden, die eigentlich katalytisch wirksamen Stellen:
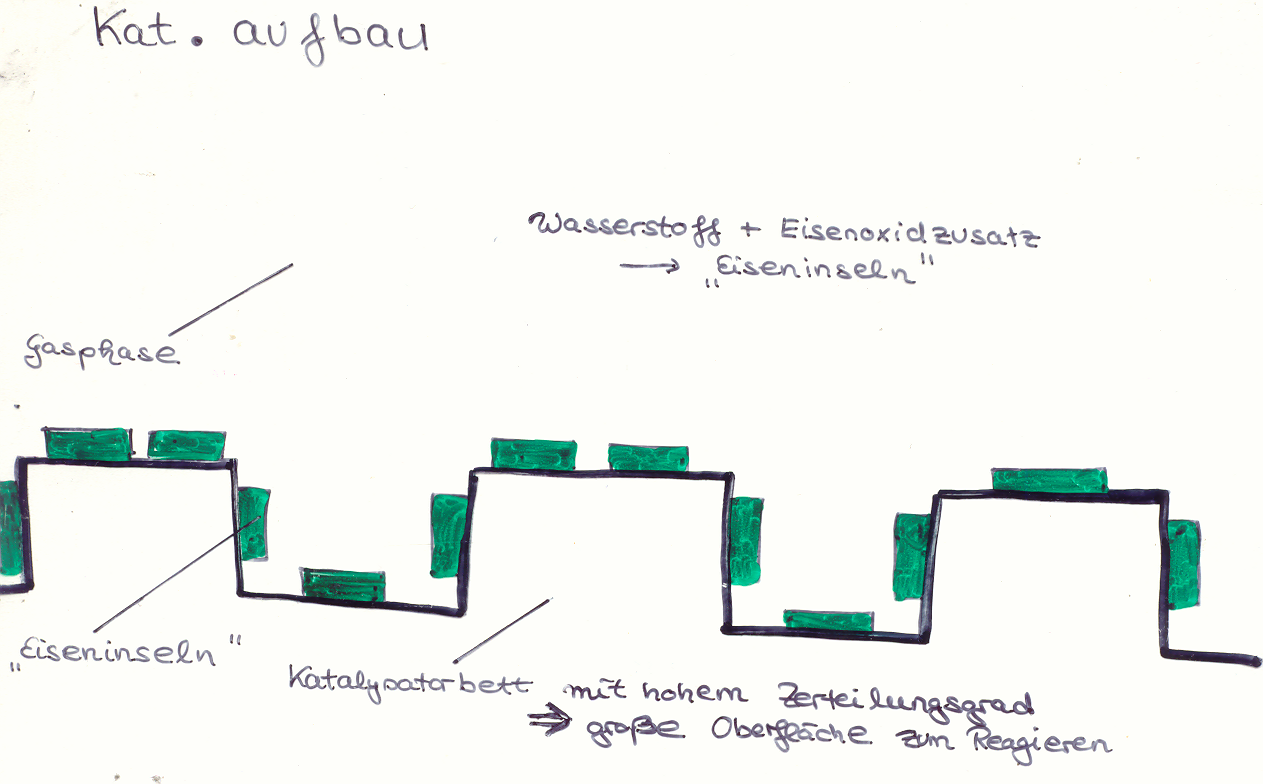
An diesen „Eisen- Inseln“ werden die Edukt-Teilchen adsorbiert. Wasserstoff- Moleküle werden dabei in Atome getrennt, Stickstoff- Moleküle ebenfalls, jedoch mit Verzögerung. Die adsorbierten Atome sind auf der Oberfläche der „Eisen- Inseln“ beweglich und wandeln sich nach und nach zu Ammoniak- Molekülen um, die durch Desorption die „Eisen- Inseln“ verlassen. Die Aktivierungsenergie der Ammoniaksynthese wird durch das Katalysatorsystem von Ea = 230 kJ (ohne Katalysator) auf etwa E’a = 10 kJ herabgesetzt. Dieser Wert hängt jedoch von der Aktivität des Katalysators ab:
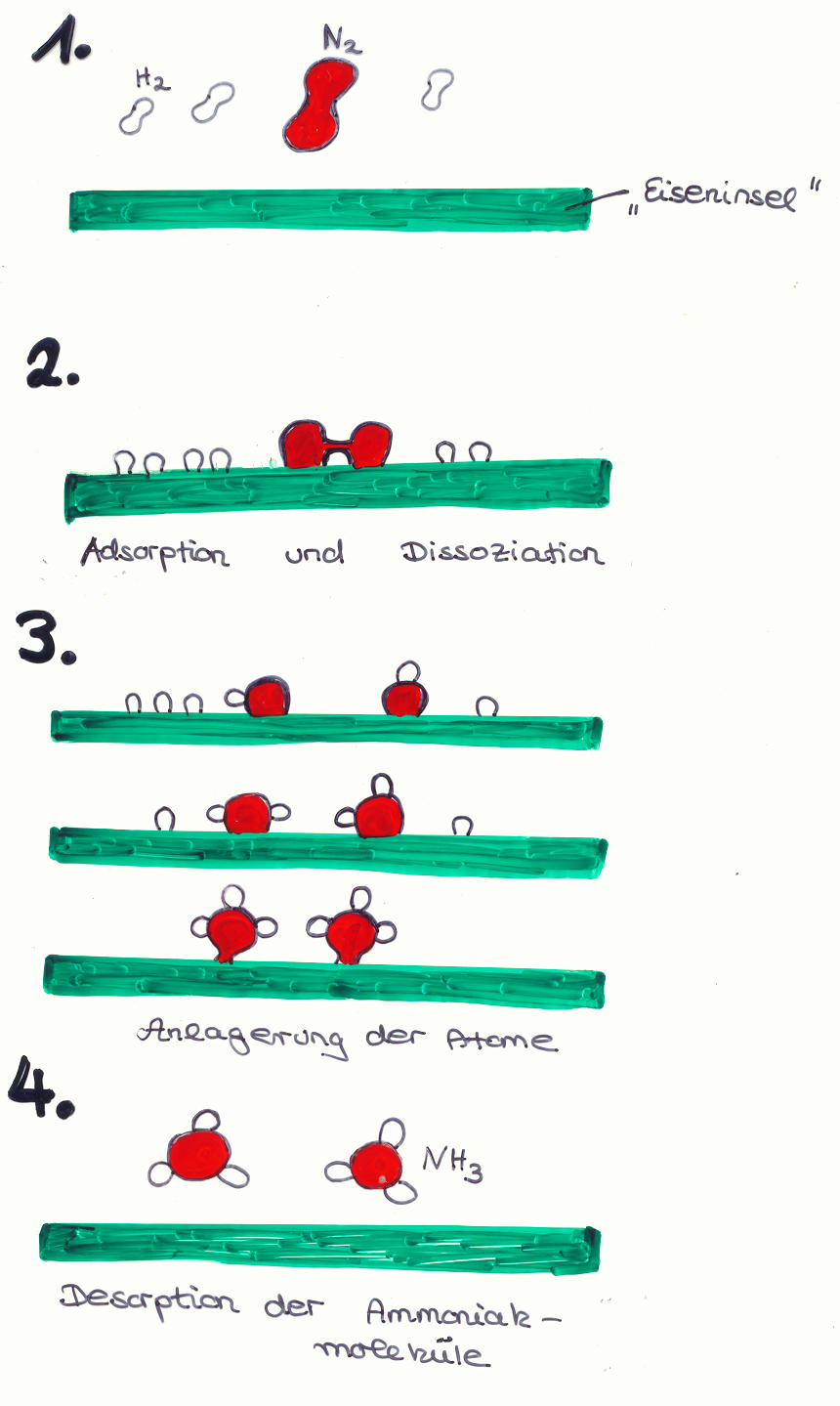
Quellen:
Tausch / v. Wachtendonk – Auflage 1993 – C.C. Buchner-Verlag – Chemie SII – 1993, S.112ff.
Flörke / Wolff – Chemie für die Jahrgangsstufen 11-13, Dümmlerverlag, 1988, S. 66
Hollemann – Wiberg, Lehrbuch der anorganischen Chemie – deGruyter-Verlag, 1971,S.331ff.
Chemische Grundlagen der Ammoniaksynthese
von Vanja Stojanova und André Babinsky
Gleichgewichtsreaktion:
N2
+ 3H2
![]() 2NH3 + ENERGIE
2NH3 + ENERGIE
Die Ammoniaksynthese (die Hinreaktion) verläuft ziemlich exotherm und mit einer Volumenverringerung (von 4 zu 2 Raumteilen) . Spezifisch ist auch die sehr hohe Aktivierungsenergie.
Reaktionsbedingungen bei Bildung von Ammoniak :
Ausgangsstoffe:
Um Wasserstoff und Stickstoff zu gewinnen, könnte man als Ausgangsstoffe Wasser (H2O) und Luft (4N2+O2) verwenden. Allerdings müsste man beide Stoffe jeweils von Sauerstoff befreien, wobei es bei Wasser chemisch gebunden und bei der Luft physikalisch beigemengt ist. Da bietet sich Kohlestoff in Form von Koks an. Dies geschieht unter hohen Temperaturen nach den folgenden Gleichungen:
4N2
+ O2 + 2C
![]() 4N2 + 2CO + ENERGIE und ENERGIE + H2O
+ C
4N2 + 2CO + ENERGIE und ENERGIE + H2O
+ C
![]() H2 + CO
H2 + CO
Generatorgas Wassergas
Wenn man die Reaktionen in dieser Reihenfolge durchführt, kann man die exotherme Energie der ersten Reaktion für die zweite direkt als Aktivierungsenergie nutzten. Das nun entstandene Kohlenoxid (CO) wird durch einen Katalysator mit Wasserdampf zu Kohlendioxid (CO2) oxidiert, das sich leicht unter Druck durch Wasser heraus waschen lässt.
Druck:
Der Prinzip vom kleinsten Zwang (Prinzip von Chatelier) lautet: „Übt man auf ein Chemisches System, das sich im Gleichgewicht befindet, einen äußeren Zwang aus, so weicht das System dem Zwang aus und es stellt sich eine neue Gleichgewichtslage ein“. Bei der Synthese von Ammoniak heißt es, das Ammoniakgleichgewicht verschiebt sich bei hohem Druck nach rechts, zugunsten der Produkte. Also braucht man eine Druckerhöhung um eine größere Ammoniakproduktion zu bekommen. Die Ammoniaksynthese verläuft nach dem Haber-Bosch-Verfahren bei Drücken von 200 bar bis 300 bar.
Temperatur:
Bei einer exothermen Reaktion, wie die Bildung von Ammoniak, muss man die Temperatur erniedrigen, damit sich das Gleichgewicht nach rechts verschiebt. Allerdings ist die Geschwindigkeit, mit der sich Stickstoff und Wasserstoff verbinden, bei Raumtemperatur fast null, d.h. die Reaktion verläuft so langsam, dass sich das Gleichgewicht niemals einstellt. Man ist also gezwungen mit einer höheren Temperatur zu arbeiten, auch wenn das nicht zugunsten der Produkte ist. Die Lösung nach dem Haber-Bosch-Verfahren ist eine Temperatur von 450oC bis 500oC in Gegenwart eines Katalysatorsystems.
Katalysator:
Durch die Verwendung eines Katalysators kann man die Aktivierungsenergie herabsetzen. Der Katalysator muss aber eine hohe Wirksamkeit haben und auch kostengünstig sein. Da bietet sich Eisen(II)-Eisen(III)-oxid an (Fe3O4). Wenn das Eduktgemisch von Wasserstoff und Stickstoff durch den Katalysator strömt, erhält man nur einen Volumenanteil von 15% - 25% Ammoniak und der Rest besteht aus nicht umgesetzten Edukten, die man aber wieder verwenden kann. Der Katalysator hat durch den hohen Zerteilungsgrad eine große Oberfläche, auf der sich durch die Reaktion von Wasserstoff mit Eisenoxid kleine „Eiseninseln“ bilden, die die eigentliche katalytische Fähigkeit haben. Dort werden die Eduktteilchen adsorbiert, d.h. der Wasserstoff wird in seine Atome gespalten und mit etwas Verzögerung ebenfalls der Stickstoff. Jetzt sind sie auf der Oberfläche beweglich und schließen sich langsam zu Ammoniak-Molekülen zusammen. Dann verlassen die Moleküle die Eiseninseln wieder durch Desorption. So wird die Aktivierungsenergie der Ammoniaksynthese von 230 kJ auf 10 kJ heruntergesetzt. Dieses Katalysatorsystem existiert schon seit 1913 und wurde seitdem kaum verändert.
Quellen :
1. Tausch/v. Wachtendonk - Chemie SII, Stoff–Formel–Umwelt - C.C. Buchners Verlag - Bamberg
1993, S.110-112
2. Hollemann – Wiberg, Lehrbuch der anorganischen Chemie – deGruyter-Verlag, 1971, S.331ff.
3. P. W. Atkins – Cemie – einfach alles – VCH-Verlag, 1998, S.532f.
Großtechnische Aspekte der Ammoniaksynthese
von Marta Chudzinski und Ying-cai Wang
Für die industrielle Ammoniakherstellung benötigt man drei Rohstoffe: Wasser, Luft und Erdgas, wobei der Preis von Ammoniak vom Preis des eingesetzten Brennstoffs Erdgas abhängt, da dieser ein fossiler Brennstoff ist. Die Industrieanlage zur Herstellung von Ammoniak besteht wesentlich aus zwei Teilen. Im ersten Teil der Anlage wird das Gasgemisch 3H2 + N2 in vier Schritten hergestellt.
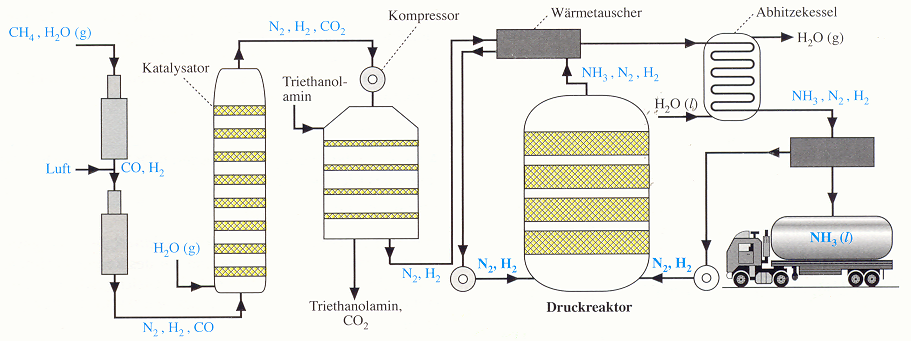
Im ersten Prozess, dem so genannten Wassergasprozess wird das Erdgas mit Wasserdampf in einem Reaktor bei 700 bis 900°C an einem Katalysator zu Wasserstoff und Kohlenstoffmonooxid umgesetzt. Dieser Vorgang verbraucht Energie.
CH4
(g) + H2O(g)
![]() CO(g) + 3 H2(g) ; HR
= +206 kJ/mol
CO(g) + 3 H2(g) ; HR
= +206 kJ/mol
Das Gasgemisch aus dieser Reaktion enthält noch etwas Methan (Erdgas), das in einem zweiten Prozess, dem so genannten Generatorprozess mit einem begrenzten Luftvolumen (Sauerstoff und Stickstoff) umgesetzt wird, wobei nur der Sauerstoff reagiert und wieder Kohlenstoffmonooxid und Wasserstoff entstehen. Der Stickstoff aus der Luft reagiert nicht und bleibt somit bestehen. Bei diesem Vorgang wird Energie in Form von Wärme freigesetzt.
2
CH4 (g) + O2 (g) + 4N2
(g)
![]() 2CO(g) + 4H2(g) + 4N2(g) ; HR
= - 71 kJ/mol
2CO(g) + 4H2(g) + 4N2(g) ; HR
= - 71 kJ/mol
Bei diesen Prozessen entstehen also Wasserstoff (H2) und Stickstoff (N2), sowie das Nebenprodukt Kohlenstoffmonooxid (CO). Dieses Kohlenstoffmonooxid muss aus dem Gasgemisch entfernt werden, da es den Katalysator, der bei der Synthese von Wasserstoff und Stickstoff zu Ammoniak verwendet wird, unbrauchbar machen würde.
Diese Entfernung von Kohlenstoffmonooxid erfolgt in den nächsten zwei Schritten. Beim Konvertierungsprozess wird Kohlenstoffmonooxid mit Wasserdampf zu Kohlenstoffdioxid (CO2) und Wasserstoff umgesetzt. Dieser Vorgang ist wiederum exotherm, was bedeutet, dass Energie freigesetzt wird.
CO(g)
+ H2O(g)
![]() CO(g) + H2(g)
; HR
= - 41 kJ/mol
CO(g) + H2(g)
; HR
= - 41 kJ/mol
Das gebildete Kohlenstoffdioxid hat den Vorteil, dass es sich im Gegensatz zu Kohlenstoffmonooxid bei hohem Druck gut in Wasser lösen lässt. Das Kohlenstoffdioxid wird im vierten Schritt, der Druckwäsche, vom Gasgemisch abgetrennt. Ein kleiner Teil des Kohlenstoffdioxids reagiert dabei mit Wasser zu Kohlensäure (H2CO3), der größte Teil wird jedoch in Wasser gelöst.
Vor Eintritt des Gasgemisches in den zweiten Teil der Industrieanlage, den Synthesereaktor, wird das Verhältnis 3 Wasserstoff zu 1 Stickstoff hergestellt. In dem Synthesereaktor findet die eigentliche Ammoniaksynthese statt.
3
H2(g) + N2(g)
![]() 2NH3(g) ; HR
= - 93 kJ/mol
2NH3(g) ; HR
= - 93 kJ/mol
Dabei bestand folgendes Problem: Da Stahl eine Legierung aus Eisen und Kohlenstoff ist, würde der Wasserstoff des Gasgemisches mit dem Kohlenstoff reagieren. Dem Stahl würde also der Kohlenstoff entzogen und übrig bliebe das reine Eisen, was zu weich ist. Ein Platzen des Reaktors wäre vorprogrammiert. Ein doppelwandiges Reaktionsrohr, welches Bosch erfand, brachte die Lösung. Die Innenwand besteht aus kohlenstofffreiem Eisen und die Außenwand aus Stahl, was die Festigkeit gewährleistet. Im Synthesereaktor herrscht ein Druck von 200 bis 300 bar. Ein höherer Druck würde zwar eine höhere Ammoniakausbeute erbringen, doch einer Druckerhöhung sind aus wirtschaftlicher und technischer Sicht Grenzen gesetzt.
Das im Synthesereaktor gebildete Ammoniak wird nach dem Austritt aus dem Reaktor abgekühlt bis es den flüssigen Zustand erreicht. Im flüssigen Zustand kann das Ammoniak vom übrigen Gasgemisch abgetrennt und in einen Tank geleitet werden. Das restliche Synthesegas (H2,N2) wird nach dem Abtrennen von Ammoniak erneut in den Synthesereaktor geleitet. Somit wird die Synthese im Kreislauf betrieben. Man nennt ein solches Verfahren auch „kontinuierliches Verfahren“.
Das aus dem Synthesereaktor austretende Gasgemisch enthält etwa 20-25% Ammoniak. Dennoch werden auf diese Weise in einem Reaktor pro Stunde etwa 50 Tonnen Ammoniak produziert.
Theoretisch könnte eine Ammoniakanlage ohne zusätzliche Energiezufuhr arbeiten und noch Energie für andere Verbraucher liefern, da die bei den exothermen Prozessen frei werdende Energie die für die Energie benötigenden Prozesse aufzuwendende Energie übersteigt. Dies gelingt allerdings nicht in der Praxis, da die „minderwertige“ Energieform Wärme erzeugt wird, man jedoch große Mengen an „hochwertiger“ elektrischer Energie benötigt.
Quellen:
1. Tausch / v. Wachtendonk – Auflage 1993 C.C. Buchner-Verlag – Chemie SII – 1993, S.112ff.
2. Dehnert, Allgemeine Chemie, Schroedel Verlag,2004, S.110f.
3. http://mitglied.lycos.de/fschemie/CH-11-Ammoniaksynthese.pdf
von Alina Kaufmann und Daniel Warwel
CH4
(g) + H2O(g)
![]() CO(g) + 3 H2(g) ; HR
= +206 kJ/mol
CO(g) + 3 H2(g) ; HR
= +206 kJ/mol
Der Wassergasprozess dient dazu, wie der Name schon andeutet Wasserstoff herzustellen. Bei dieser Reaktion reagiert Wasserdampf bei einer Temperatur von ca. 800- 900°C und einem Druck von 25 bar mit einem leichten Kohlenwasserstoff. Als leichte Kohlenwasserstoffe bezeichnet man z.B. Methan, die Reaktion ist bis hin zu Naphtha möglich. Diese endotherme Reaktion wird mit einem Nickel- Aluminiumoxid Katalysator beschleunigt. Neben Wasserstoff entsteht bei diesem Wassergasprozess noch Kohlenmonoxid. Der Dampf Reforming Prozess hat im Vergleich zu anderen Verfahren die höchste Ausbeute, er wird von einem Überschuss an Dampf und niedrigem Druck bevorteilt.
2. Generatorprozess
2
CH4 (g) + O2 (g) + 4N2
(g)
![]() 2CO(g) + 4H2(g) + 4N2(g) ; HR
= - 71 kJ/mol
2CO(g) + 4H2(g) + 4N2(g) ; HR
= - 71 kJ/mol
Bei diesem Prozess wird der überschüssige leichte Kohlenwasserstoff in einem begrenzten Luftvolumen verbrannt. Die exotherme Reaktion bildet Kohlenstoffmonoxid und Wasserstoff während der Stickstoff der Luft nicht reagiert. Die Reaktion wird so gesteuert, dass die für die Ammoniaksynthese notwendige Menge in das Gasgemisch gelangt.
3. Konvertierung von Kohlenstoffmonoxid (Shiftreaktion)
CO(g)
+ H2O(g)
![]() CO(g) + H2(g)
; HR
= - 41 kJ/mol
CO(g) + H2(g)
; HR
= - 41 kJ/mol
Das in den Prozessen 1. und 2. entstandene Gasgemisch wird nun in zwei Schritten von dem, bei der eigentlichen Ammoniaksynthese als Katalysatorgift wirkenden Kohlenmonooxid befreit. Das Gemisch wird zunächst mit Wasserdampf gesättigt und in den Wasserstoffkontaktofen eingeführt. Dieser hat zwei getrennte Kontakträume. Im ersten Raum befinden sich übereinander angeordnete durchlochte Eisenbleche welche als Katalysator wirken und ca. 95% des Kohlenmonoxids zu Kohlendioxid oxidieren. Diese exotherme Reaktion findet bei ca. 550- 580°C statt. Im zweiten Raum wird der Kohlenmonoxid Anteil dann bei ca. 400- 420°C auf weniger als 1% reduziert.
4. Entfernung des Kohlendioxids durch Druckwäsche
Kohlenstoffdioxid löst sich im Gegensatz zu Kohlenmonooxid bei höherem Druck gut in Wasser. Bei der Druckwäsche reagiert ein kleiner Teil des Kohlenstoffdioxids mit Wasser zu Kohlensäure( H2CO3); der größte Teil wird in Wasser gelöst.
Energetisch fallen diese Vorgänge nicht ins Gewicht.
Hochdruckreaktion
3
H2(g) + N2(g)
![]() 2NH3(g) ; HR
= - 93 kJ/mol
2NH3(g) ; HR
= - 93 kJ/mol
Im Synthesereaktor findet die eigentliche Ammoniaksynthese statt. Entscheidend für eine Ammoniak-Anlage ist der Druck. Nach dem Prinzip vom kleinsten Zwang verschiebt sich das Ammoniakgleichgewicht bei hohem Druck in die Richtung der Produkte. Durch den werden einerseits kleinere Apparaturen genutzt und die Produktivität gesteigert, andererseits ist ein hoher Energieaufwand für die Verdichtung des Synthesegasgemisches notwendig. Zusätzlich werden durch den Druck hohe Anforderungen an die Materialien und an die Bauart der Technischen Anlage gestellt. Die Ammoniaksynthese läuft bei einem Druck von 200. 300 bar ab. Höherer Druck würde zwar das Gleichgewicht noch weiter in Richtung der Produkte verlagern und wäre daher chemisch gesehen noch effektiver, bei höherem Druck sind allerdings wegen der Investitionskosten und den zunehmenden technischen Problemen bei der Herstellung des Drucks Grenzen gesetzt.
Temperatur und Wirkweise des Katalysators im Hochdruckreaktor
Der Katalysator im Synthesereaktor besteht im wesentlichen aus Eisenoxid, das mit verschiedenen Zusätzen wie Aluminiumoxid oder Calciumoxid versetzt ist. Entscheidend für die Reaktion ist die Temperatur und die Oberflächenstruktur des Katalysators. Durch einen hohen Zerteilungsgrad erhält der Katalysator eine sehr große Oberfläche. Auf ihr bilden sich kleine „Inseln“ aus Eisen, die eigentlich katalytisch wirksamen Stellen. Die Temperatur im Synthesereaktor wird durch den Temperaturbereich bestimmt, in dem der Katalysator aktiv ist. Während das Synthesegasgemisch durch die Röhren mit dem Katalysator strömt, werden die Rohre außen mit Gasgemisch umspült, das die Reaktionswärme von der Synthese aufnimmt und eine Überhitzung des Reaktors verhindert. Die Temperatur beträgt 400 – 500°C. Sie ist also ein Kompromiss zwischen einer günstigen Gleichgewichtslage und dem Ziel einer hohen Reaktionsgeschwindigkeit.
Auffangen des Ammoniaks
In mehreren Stufen wird dem Ammoniak die Wärme entzogen. Dabei wird unter anderem bei der Kühlung mit Wasser Wasserdampf erzeugt, der einerseits zur Stromerzeugung und andererseits für die Gewinnung der Ausgangsstoffe genutzt werden kann. In einem ersten Schritt wird das Ammoniakgas verflüssig, auf diese Weise kann es in einem zweiten Schritt abgetrennt und in einen Tank aufgefangen werden. Das restliche Synthesegas verlässt zwar auch mit dem abgetrennten flüssigen Ammoniak den Reaktor, wird nach Abtrennung des flüssigen Ammoniaks allerdings komprimiert und dem Hochdruckreaktor mit frischem Synthesegas wieder zugeführt. Das Verfahren wird also im Kreislauf betrieben ( kontinuierliches Verfahren). Durch den ständigen Entzug des Reaktionsproduktes verschiebt sich das Gleichgewicht in die Richtung der Produkte und die Produktion wird gesteigert. Obwohl das Gasgemisch beim Austritt aus dem Synthesereaktor nur einen Volumenanteil von etwa 20- 25% Ammoniak enthält, können auf diese Weise in einem Reaktor pro Stunde ca. 50t Ammoniak produziert werden.
Die bei der exothermen Reaktion anfallende Energie reicht theoretisch dafür aus, den gesamten Reaktor ohne weitere Energiezufuhr zu betreiben, und sogar noch weiterhin Energie für andere Verbraucher zu liefern. Jedoch gibt es zwei Gründe wieso dies nicht der Fall ist:
Die Energieverluste sind relativ groß
Elektrische Energie kann mit hohem Gewinn in andere Energieformen umgewandelt werden, Wärme jedoch kann nur mit sehr niedrigem Gewinn in elektrische Energie umgewandelt werden, und bei der Reaktion wird Energie in Form von Wärme erzeugt, aber für den Antrieb der Kompressoren wird Energie in Form von elektrischer Energie benötigt. Also kann die bei der Reaktion anfallende Wärmeenergie nicht in vollem Maße für den Antrieb des Reaktors benutzt werden.
Deshalb werden noch ca. 600kWh/t Ammoniak benötigt, um den Reaktor zu betreiben. So können mehr als 3000t Ammoniak an einem Produktionstag gewonnen werden. Aber aufgrund der hohen Druck- und Temperaturverhältnisse bei der Synthese des Ammoniaks entfallen ca. 3 % des Weltenergieverbrauchs auf das Haber-Bosch-Verfahren.
Der Preis des Ammoniaks hängt vom Preis der fossilen Brennstoffe (Kohle, Erdgas), die bei der Synthese benötigt werden um Wasserstoff und Stickstoff zu gewinnen ab.
Quellen:
1. http://mitglied.lycos.de/fschemie/CH-11-Ammoniaksynthese.pdf
2. http://lexikon.freenet.de/wasserstoffherstellung
3. http:///www.hyweb.de/Wissen/BWK.htm
4. http://www.hyweb.de/Wissen/w-i-energiew3.html
http:///www.linde-anlagenbau.de/de/p0001/p0017/p0020/p0020.php
6. Tausch / v. Wachtendonk – Auflage 1993 C.C. Buchner-Verlag – Chemie SII – 1993, S.112ff.